
- •Лекция 6.
- •Глава 3. Основы молекулярной физики и термодинамики.
- •§1.Основные понятия.
- •Внешние.
- •Внутренние.
- •§2.Законы идеальных газов.
- •Р Дано: , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , , , , ешение:
- •Р Дано: , , ешение:
- •§3.Молекулярно-кинетическая теория газов.
- •Распределение частиц во внешних полях.
- •Опытное обоснование молекулярно-кинетической теории.
- •Р Дано: , , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , ешение:
- •Лекции 7-8.
- •§4.Физические основы термодинамики. Внутренняя энергия системы.
- •Теплообмен. Явления переноса.
- •Вакуум и методы его получения.
- •Работа.
- •Первый закон термодинамики.
- •Р Дано: , , ешение:
- •Решение:
- •Обратимые и необратимые процессы.
- •Энтропия.
- •Круговые процессы. Цикл Карно.
- •Второй закон термодинамики.
- •Третий закон.
- •Р Дано: , , , , ешение:
- •Р Дано: , , , ешение:
- •Решение:
- •Решение:
- •Решение:
- •§5.Реальные газы. Жидкости. Реальные газы.
- •Изотермы реальных газов.
- •Решение:
- •Решение:
- •Решение:
- •Решение:
- •Решение:
Р Дано: , , ешение:
П оскольку
коэффициенты теплового расширения для
твердых тел значительно меньше
(приблизительно в 100 раз), чем для газа,
в условиях данной задачи можно пренебречь
расширением баллона и считать процесс
нагревания газа изохорным. В зависимости
от того, применять ли непосредственно
первое начало термодинамики или формулу,
определяющую теплоемкость тела, возможны
два способа решения.
оскольку
коэффициенты теплового расширения для
твердых тел значительно меньше
(приблизительно в 100 раз), чем для газа,
в условиях данной задачи можно пренебречь
расширением баллона и считать процесс
нагревания газа изохорным. В зависимости
от того, применять ли непосредственно
первое начало термодинамики или формулу,
определяющую теплоемкость тела, возможны
два способа решения.
Применим первое начало термодинамики. При изохорном процессе и
 ,
т.к.
,
т.к.
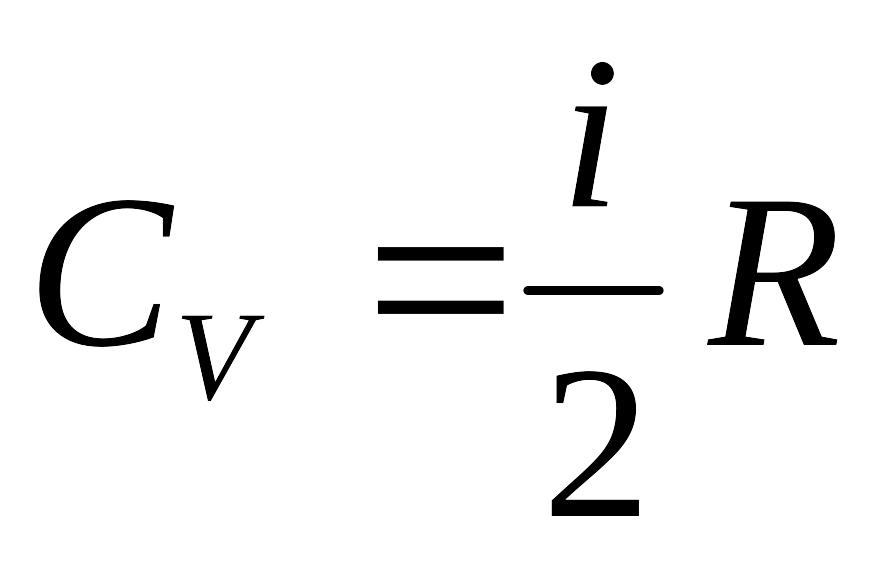 ,
то
,
то
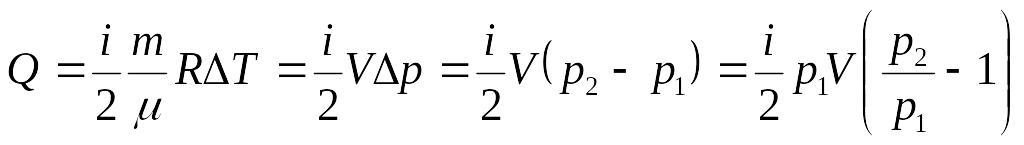 .
Заменяя по закону Шарля отношение
давлений
.
Заменяя по закону Шарля отношение
давлений
 отношением абсолютных температур
отношением абсолютных температур
 получим
получим
 .
Т.к. кислород двухатомный газ, то
.
Т.к. кислород двухатомный газ, то
 .
.Из формулы (3.4.5) для молярной теплоемкости следует, что элементарное количество теплоты, сообщенное телу при повышении его температуры на
 ,
равно
,
равно
 .
Число молей
найдем из уравнения газового состояния:
.
Число молей
найдем из уравнения газового состояния:
 .
Т.к.
газ
нагревается
при
постоянном
объеме,
то
.
Т.к.
газ
нагревается
при
постоянном
объеме,
то
 ,
где по (3.4.11)
,
где по (3.4.11)
 ,откуда
,откуда


 .
.
Ответ:
![]() .
.
Пример 3.4.2. Сколько теплоты поглощают 200 г водорода, нагреваясь от 00С до 1000С при постоянном давлении? Каков будет прирост внутренней энергии газа? Какую работу совершит газ?
Решение:
Теплота
при изобарическом нагревании
![]() ,
где
и
,
где
и
![]() .
.
Внутренняя
энергия
![]() т.е. изменение внутренней энергии
т.е. изменение внутренней энергии
![]() .
Работа
расширения
по первому
началу термодинамики
.
Работа
расширения
по первому
началу термодинамики
![]() .
Работа, совершаемая газом
.
Работа, совершаемая газом
![]() .
.
П ример
3.4.3. Кислород
массой 2 кг занимает объем 1 м3
и находится под давлением 2 атм. Газ был
нагрет сначала при постоянном давлении
до объема 3 м3,
а затем при постоянном объеме до давления
5 атм. Найти изменение внутренней энергии
газа, совершенную им работу и теплоту,
переданную газу. Построить график
процесса.
ример
3.4.3. Кислород
массой 2 кг занимает объем 1 м3
и находится под давлением 2 атм. Газ был
нагрет сначала при постоянном давлении
до объема 3 м3,
а затем при постоянном объеме до давления
5 атм. Найти изменение внутренней энергии
газа, совершенную им работу и теплоту,
переданную газу. Построить график
процесса.
И
Дано:
![]() ,
,![]() ,
,
![]()
![]() ,
,![]()
![]()
 зменение
внутренней энергии
зменение
внутренней энергии
![]() ,
где
.
Начальную и конечную температуру найдем
с помощью уравнения Менделеева –
Клапейрона:
,
где
.
Начальную и конечную температуру найдем
с помощью уравнения Менделеева –
Клапейрона:
![]()
![]() .
Т.к.
.
Т.к.
![]() ,
то
,
то
![]() .
.
![]() .
Работа расширения газа при постоянном
давлении
.
Работа расширения газа при постоянном
давлении
![]() .
Работа газа, нагреваемого при постоянном
объеме
.
Работа газа, нагреваемого при постоянном
объеме
![]() .
Полная работа
.
Полная работа
![]() .
По первому началу термодинамики
.
По первому началу термодинамики
![]() .
.
Обратимые и необратимые процессы.
Опр.3.4.11. Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
Опр.3.4.12. Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Все реальные процессы протекают с конечной скоростью. Они сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. Следовательно, все они неравновесны и необратимы.
Всякий необратимый процесс в одном направлений (прямом) протекает самопроизвольно, а для осуществления его в обратном направлении так, чтобы система вернулась в первоначальное состояние, требуется компенсирующий процесс во внешних телах, в результате которого состояния этих тел .оказываются отличными от первоначальных. Например, процесс выравнивания температур двух соприкасающихся различно нагретых тел идет самопроизвольно, т. е. не связан с необходимостью одновременного существования каких-либо процессов в других (внешних), телах. Однако для осуществления обратного процесса увеличения разности температур тел до первоначальной нужны компенсирующие процессы во внешних телах, обусловливающие, например, работу холодильной машины
