
- •1) Основные сведения о строении атомов.
- •2) Характеристика энергетического состояния электрона квантовыми числами: главное, орбитальное, магнитное, спиновое.
- •3) Емкость энергетических уровней и подуровней. Правило Хунда и Клечковского.
- •4) Структура пс: периоды, группы, подгруппы. Периодичность свойств элементов и веществ; s-, p-,d-, f- электронные семейства.
- •5) Размеры атомов и ионов.
- •6) Способы выражения концентрации растворов: молярность, моляльность, нормальность, процентная и мольная доли.
- •7) Эквивалент и эквивалентная масса.
- •8) Способы определения эквивалентной массы оксида, кислоты, основания и соли.
- •9) Закон эквивалентов и его применение для решения задач.
- •10) Природа химической связи. Основные виды связи: ковалентная, ионная, водородная, металлическая, межмолекулярное взаимодействие.
- •11) Основные характеристики химической связи: энергия, длина, направленность, кратность, полярность.
- •12) Гибридизация атомных электронных орбиталей. Пространственная конфигурация молекул.
- •13) Энергетические эффекты химических реакций. Эндо- и экзотермические реакции.
- •14) Стандартные теплоты образования веществ. Термохимические расчеты.
- •15) Понятие о внутренней энергии системы, об энтальпии и её изменениях в химических процессах.
- •16) Энергия Гиббса. Условия самопроизвольного протекания реакции.
- •17) Гомогенные и гетерогенные системы.
- •18) Скорость химических реакций. Зависимость скорости химических реакций от концентрации, температуры, давления, наличия катализаторов.
- •19) Константа скорости химической реакции. Закон действующих масс.
- •20) Энергия активации химической реакции. Активные молекулы. Активированный комплекс.
- •21) Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье.
- •1) Температура
- •2) Давление
- •3) Концентрация исходных веществ и продуктов реакции
- •22) Гомогенный и гетерогенный катализ.
- •23) Электролитическая диссоциация и причины её возникновения.
- •25) Сильные и слабые электролиты.
- •26) Степень и константа диссоциации слабых электролитов.
- •27) Коэффициент активности. Ионная сила растворов.
- •28) Обменные реакции в растворах электролитов. Гидролиз солей. Ступенчатый гидролиз.
- •29) Степень и константа гидролиза.
- •30) Произведение растворимости.
- •Степень окисления элемента.
- •Окислительные и восстановительные свойства простых веществ и химических соединений.
- •33) Составление уравнений овр. Влияние среды на протекание овр. Важнейшие окислители и восстановители.
- •Электродные потенциалы. Гальванические элементы.
- •35) Водородный электрод. Ряд стандартных электродных потенциалов и использование их для определения направленности процесса в овр.
- •36) Электролиз, его сущность.
- •37) Законы Фарадея при электролизе.
- •38) Растворы неэлектролитов. Классификация растворов.
- •39) Дисперсные системы. Состав. Классификация по размеру частиц.
- •40) Разновидности дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды.
- •41) Лиофильные и лиофобные дисперсные системы. Строение коллоидных частиц.
- •42) Получение коллоидов. Применение золей и гелей. Методы диспергирования
- •Конденсационные методы
- •43) Полимеры. Строение полимеров, получение (реакции полимеризации и поликонденсации). Примеры.
- •44) Классификация полимеров по происхождению. Примеры.
- •45) Классификация полимеров по свойствам.
- •46) Физико-химические методы исследования строения вещества.
- •47) Коррозия, понятие, виды и причины появления. Методы защиты от коррозии.
11) Основные характеристики химической связи: энергия, длина, направленность, кратность, полярность.
Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Энергия связи (для данного состояния системы) — разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя:
![]() где:
где:
— энергия связи компонентов в системе из i компонент (частиц),
![]() —
полная
энергия i-го компонента в несвязаннном
состоянии (бесконечно удалённой
покоящейся частицы)
—
полная
энергия i-го компонента в несвязаннном
состоянии (бесконечно удалённой
покоящейся частицы)
— полная энергия связанной системы.Вид связи
Энергия связи, кДж/моль
Свойства
Ковалентная
400
Высокие твердость, прочность, температуры кипения и плавления
Ионная
250
Хрупкость
Металлическая
150
Высокая пластичность
Водородная
60
Низкие твердость, прочность, температуры кипения и плавления
Вандерваальсова
40
Длина связи – это расстояние между ядрами взаимодействующих атомов.
Длины химической связи были определены экспериментально для огромного числа молекул.
В большинстве случаев - чем больше энергия связи, тем меньше длина связи.
Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие
связи, то связь направлена, если таких направлений нет – то ненаправлена.
Кратность связи - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной
химической связи.
Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной
плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра.
Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны.
12) Гибридизация атомных электронных орбиталей. Пространственная конфигурация молекул.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных.
Пример:
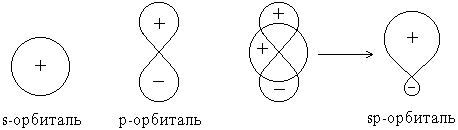
Перекрывание sp-орбиталей бериллия
и p-орбиталей хлора в молекуле
BeCl2
:

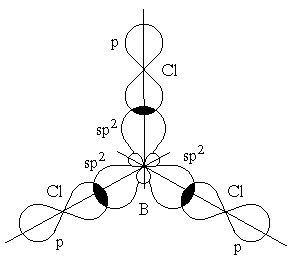
Перекрывание
sp2-орбиталей
бора и p-орбиталей хлора в молекуле
BCl3
:
Конфигурация молекул, в стереохимии характеризует пространственное расположение атомов или групп атомов у асимметрического атома, у несимметрично замещенной двойной связи, у малого (жёсткого) цикла, у центрального атома в комплексах.
