
- •1) Основные сведения о строении атомов.
- •2) Характеристика энергетического состояния электрона квантовыми числами: главное, орбитальное, магнитное, спиновое.
- •3) Емкость энергетических уровней и подуровней. Правило Хунда и Клечковского.
- •4) Структура пс: периоды, группы, подгруппы. Периодичность свойств элементов и веществ; s-, p-,d-, f- электронные семейства.
- •5) Размеры атомов и ионов.
- •6) Способы выражения концентрации растворов: молярность, моляльность, нормальность, процентная и мольная доли.
- •7) Эквивалент и эквивалентная масса.
- •8) Способы определения эквивалентной массы оксида, кислоты, основания и соли.
- •9) Закон эквивалентов и его применение для решения задач.
- •10) Природа химической связи. Основные виды связи: ковалентная, ионная, водородная, металлическая, межмолекулярное взаимодействие.
- •11) Основные характеристики химической связи: энергия, длина, направленность, кратность, полярность.
- •12) Гибридизация атомных электронных орбиталей. Пространственная конфигурация молекул.
- •13) Энергетические эффекты химических реакций. Эндо- и экзотермические реакции.
- •14) Стандартные теплоты образования веществ. Термохимические расчеты.
- •15) Понятие о внутренней энергии системы, об энтальпии и её изменениях в химических процессах.
- •16) Энергия Гиббса. Условия самопроизвольного протекания реакции.
- •17) Гомогенные и гетерогенные системы.
- •18) Скорость химических реакций. Зависимость скорости химических реакций от концентрации, температуры, давления, наличия катализаторов.
- •19) Константа скорости химической реакции. Закон действующих масс.
- •20) Энергия активации химической реакции. Активные молекулы. Активированный комплекс.
- •21) Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье.
- •1) Температура
- •2) Давление
- •3) Концентрация исходных веществ и продуктов реакции
- •22) Гомогенный и гетерогенный катализ.
- •23) Электролитическая диссоциация и причины её возникновения.
- •25) Сильные и слабые электролиты.
- •26) Степень и константа диссоциации слабых электролитов.
- •27) Коэффициент активности. Ионная сила растворов.
- •28) Обменные реакции в растворах электролитов. Гидролиз солей. Ступенчатый гидролиз.
- •29) Степень и константа гидролиза.
- •30) Произведение растворимости.
- •Степень окисления элемента.
- •Окислительные и восстановительные свойства простых веществ и химических соединений.
- •33) Составление уравнений овр. Влияние среды на протекание овр. Важнейшие окислители и восстановители.
- •Электродные потенциалы. Гальванические элементы.
- •35) Водородный электрод. Ряд стандартных электродных потенциалов и использование их для определения направленности процесса в овр.
- •36) Электролиз, его сущность.
- •37) Законы Фарадея при электролизе.
- •38) Растворы неэлектролитов. Классификация растворов.
- •39) Дисперсные системы. Состав. Классификация по размеру частиц.
- •40) Разновидности дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды.
- •41) Лиофильные и лиофобные дисперсные системы. Строение коллоидных частиц.
- •42) Получение коллоидов. Применение золей и гелей. Методы диспергирования
- •Конденсационные методы
- •43) Полимеры. Строение полимеров, получение (реакции полимеризации и поликонденсации). Примеры.
- •44) Классификация полимеров по происхождению. Примеры.
- •45) Классификация полимеров по свойствам.
- •46) Физико-химические методы исследования строения вещества.
- •47) Коррозия, понятие, виды и причины появления. Методы защиты от коррозии.
37) Законы Фарадея при электролизе.
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
![]()
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется
электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
![]() ,
где z —
валентность атома (иона) вещества, e —
заряд электрона
,
где z —
валентность атома (иона) вещества, e —
заряд электрона
Подставляя (2)-(5) в (1), получим
![]()
![]()
Где
![]() - постоянная Фарадея.
- постоянная Фарадея.
![]()
![]()
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
![]()
Где
![]() — постоянная Фарадея.
— постоянная Фарадея.
Второй
закон Фарадея записывается в следующем
виде:
![]()
38) Растворы неэлектролитов. Классификация растворов.
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов. в растворы неэлектролитов (мол. растворах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. растворы неэлектролитов могут быть твердыми, жидкими и газообразными.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
39) Дисперсные системы. Состав. Классификация по размеру частиц.
Диспе́рсная систе́ма — это образованная из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
По размерам частиц свободнодисперсные системы подразделяют на:
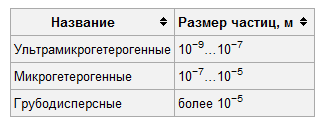
Связнодисперсные системы (пористые тела) по классификации М. М. Дубинина подразделяют на:

40) Разновидности дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Разновидности дисперсных систем по агрегатному состоянию дисперсной фазы:
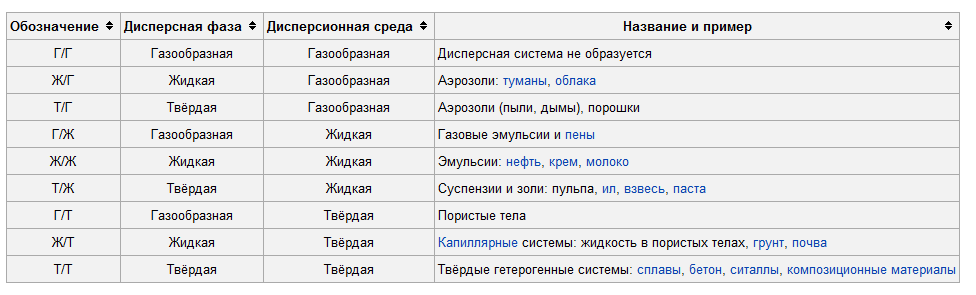
41) Лиофильные и лиофобные дисперсные системы. Строение коллоидных частиц.
Лиофильные и лиофобные дисперсные системы с жидкой дисперсионной средой различаются в зависимости от того, насколько близки
или различны по своим свойствам дисперсная фаза и дисперсионная среда. В лиофильных дисперсных системах межмолекулярные взаимодействия по обе стороны разделяющей фазы поверхности различаются незначительно, поэтому удельная свободная поверхностная энергия (для жидкости - поверхностное натяжение) чрезвычайно мала (обычно сотые доли мДж/м2), межфазная граница (поверхностный слой) может быть размыта и по толщине нередко соизмерима с размером частиц дисперсной фазы. Лиофильные дисперсные системы термодинамически равновесны, они всегда высокодисперсны, образуются самопроизвольно и при сохранении условий их возникновения могут существовать сколь угодно долго. Типичные лиофильные дисперсные системы - микроэмульсии. некоторые полимер-полимерные смеси, мицеллярные системы ПАВ, Дисперсные системы с жидкокристаллическими дисперсными фазами. К лиофильным дисперсным системам часто относят также набухающие и самопроизвольно диспергирующиеся в водной среде минералы группы монтмориллонита, например, бентонитовые глины.
Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Рассмотрим строение
коллоидной частицы кремниевой кислоты, которая образовалась в результате взаимодействия очень разбавленных растворов силиката натрия и соляной кислоты (Na2Si03 + 2HCl = H2Si03 + 2NaCl). Если Na2Si03 находится в избытке, то кремниевая кислота не выпадает в осадок, а образуется прозрачный коллоидный раствор H2Si03. Ядро коллоидной частицы нейтрально, оно состоит из m молекул H2Si03. На поверхности ядра адсорбируются n ионов Si032- , это потенциалопределяющие ионы, так как они обуславливают заряд частицы коллоидного раствора.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака — противоионы. В данном случае это ионы Na+, причем часть их 2(n - х) адсорбируется на частице. Адсорбированные ионы Si032- вместе с противоионами Na+ образуют адсорбционный слой. Другая часть противоионов 2xNa+ находится в жидкой фазе и образует подвижный диффузный слой.
Ядро вместе с адсорбционным слоем называется гранулой.
В нашем примере гранула заряжена отрицательно, так как адсорбция ионов Si032- происходит сильнее, чем ионов Na-.
Коллоидная частица вместе с противоионами диффузионного слоя называется мицеллой. Это отдельная частица коллоидного раствора.
Мицелла (коллоидная частица)
