
- •1) Основные сведения о строении атомов.
- •2) Характеристика энергетического состояния электрона квантовыми числами: главное, орбитальное, магнитное, спиновое.
- •3) Емкость энергетических уровней и подуровней. Правило Хунда и Клечковского.
- •4) Структура пс: периоды, группы, подгруппы. Периодичность свойств элементов и веществ; s-, p-,d-, f- электронные семейства.
- •5) Размеры атомов и ионов.
- •6) Способы выражения концентрации растворов: молярность, моляльность, нормальность, процентная и мольная доли.
- •7) Эквивалент и эквивалентная масса.
- •8) Способы определения эквивалентной массы оксида, кислоты, основания и соли.
- •9) Закон эквивалентов и его применение для решения задач.
- •10) Природа химической связи. Основные виды связи: ковалентная, ионная, водородная, металлическая, межмолекулярное взаимодействие.
- •11) Основные характеристики химической связи: энергия, длина, направленность, кратность, полярность.
- •12) Гибридизация атомных электронных орбиталей. Пространственная конфигурация молекул.
- •13) Энергетические эффекты химических реакций. Эндо- и экзотермические реакции.
- •14) Стандартные теплоты образования веществ. Термохимические расчеты.
- •15) Понятие о внутренней энергии системы, об энтальпии и её изменениях в химических процессах.
- •16) Энергия Гиббса. Условия самопроизвольного протекания реакции.
- •17) Гомогенные и гетерогенные системы.
- •18) Скорость химических реакций. Зависимость скорости химических реакций от концентрации, температуры, давления, наличия катализаторов.
- •19) Константа скорости химической реакции. Закон действующих масс.
- •20) Энергия активации химической реакции. Активные молекулы. Активированный комплекс.
- •21) Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье.
- •1) Температура
- •2) Давление
- •3) Концентрация исходных веществ и продуктов реакции
- •22) Гомогенный и гетерогенный катализ.
- •23) Электролитическая диссоциация и причины её возникновения.
- •25) Сильные и слабые электролиты.
- •26) Степень и константа диссоциации слабых электролитов.
- •27) Коэффициент активности. Ионная сила растворов.
- •28) Обменные реакции в растворах электролитов. Гидролиз солей. Ступенчатый гидролиз.
- •29) Степень и константа гидролиза.
- •30) Произведение растворимости.
- •Степень окисления элемента.
- •Окислительные и восстановительные свойства простых веществ и химических соединений.
- •33) Составление уравнений овр. Влияние среды на протекание овр. Важнейшие окислители и восстановители.
- •Электродные потенциалы. Гальванические элементы.
- •35) Водородный электрод. Ряд стандартных электродных потенциалов и использование их для определения направленности процесса в овр.
- •36) Электролиз, его сущность.
- •37) Законы Фарадея при электролизе.
- •38) Растворы неэлектролитов. Классификация растворов.
- •39) Дисперсные системы. Состав. Классификация по размеру частиц.
- •40) Разновидности дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды.
- •41) Лиофильные и лиофобные дисперсные системы. Строение коллоидных частиц.
- •42) Получение коллоидов. Применение золей и гелей. Методы диспергирования
- •Конденсационные методы
- •43) Полимеры. Строение полимеров, получение (реакции полимеризации и поликонденсации). Примеры.
- •44) Классификация полимеров по происхождению. Примеры.
- •45) Классификация полимеров по свойствам.
- •46) Физико-химические методы исследования строения вещества.
- •47) Коррозия, понятие, виды и причины появления. Методы защиты от коррозии.
Электродные потенциалы. Гальванические элементы.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте
электролитом (чаще всего между металлом и раствором электролита).
Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип
действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Сейчас широко распространены следующие гальванические элементы:
Тип ЭДС (В) Достоинства
угольно-цинковые (солевые) 1,5 дешёвые
щелочные (жаргонное название — алкалиновые) 1,6 высокий ток, ёмкие
никельоксигидроксидные (NiOOH) 1,6 высокий ток,очень ёмкие
литиевые 3,0 очень высокий ток, очень ёмкие
35) Водородный электрод. Ряд стандартных электродных потенциалов и использование их для определения направленности процесса в овр.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных
электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода.
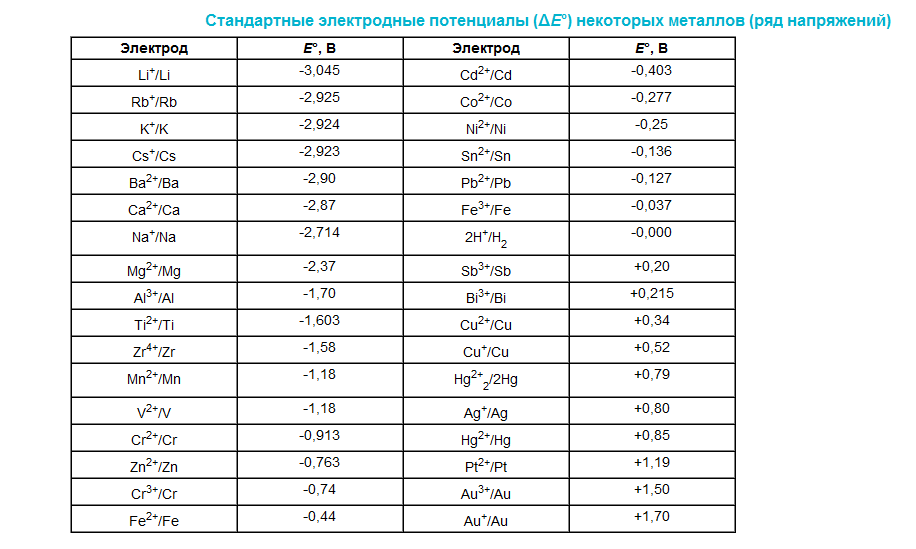
36) Электролиз, его сущность.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование).
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
