
- •3) Прокариотные и эукариотные микроорганизмы, основные различия.
- •4) Морфология прокариот.
- •Г). Элективные (избирательные) среды
- •Аэробное дыхание
- •3. Аэробные хемоорганотрофные бактерии
- •Метанотрофы и метилотрофы
- •Нитратное дыхание
- •Сульфатное дыхание
- •Серное дыхание
- •Карбонатное дыхание
- •«Железное» дыхание
- •Архебактерии и эубактерии
- •Альфа-Гемолиз
- •Бета-Гемолиз
1) Предмет и задачи микробиологии. Основные направления развития современной микробиологии: общая, медицинская, санитарная, ветеринарная, промышленная, почвенная, водная, космическая, геологическая, генетика микроорганизмов, экология микроорганизмов.
После открытия микроорганизмов прошло три столетия, и наука занимающиеся их изучением - МИКРОБИОЛОГИЯ - заняла достойное место среди других биологических и медицинских наук. Микроорганизмы широко распространены в природе. Они находятся в воздухе, почве, пище, на окружающих нас предметах, на поверхности и внутри нашего организма. Такое широкое распространение микробов свидетельствует об их значительной роли в природе и жизни человека. Микроорганизмы обуславливают круговорот веществ в природе, осуществляют расщепление органических соединений и синтез белка. С помощью микроорганизмов происходят важные производственные процессы : хлебопечение, производство ферментов, гормонов, антибиотиков и других в-вв. Наряду с полезными микроорганизмами существует группа патогенных микробов - возбудители различных заболеваний человека, животных, растений. Микроорганизмы были открыты в конце 18 века, но микробиология как наука сформировалась только в начале 19 века, после гениальных открытий французского ученого Луи Пастера. В связи с огромной ролью и задачами микробиологи не может справится со всеми вопросами в пределах одной дисциплины и в следствие этого происходит ее дифференцировка в различные дисциплины. Общая микробиология - изучает морфологию, физиологию, биохимию микроорганизмов, их роль в круговороте в-в и распространение в природе. Техническая микробиология - входит изучение микробов участвующих в производстве антибиотиков, спиртов, витаминов, также разработка методов защиты материалов от воздействия микроорганизмов. Сельскохозяйственная микробиология - изучает роль и значение микробов в формирование структуры почвы, ее плодородия, минерализация и питание растений. Ветеринарная микробиология - изучает возбудители заболеваний у животных, разрабатывает методы специфической профилактики и терапии инфекционных заболеваний. Медицинская микробиология - рассматривает свойства патогенных и условно - патогенных микробов, их роль в развитие инфекционного процесса и иммунного ответа, разрабатывает методы лабораторной диагностики и специфической профилактики и терапии инфекционных заболеваний. Вирусология - изучает неклеточные микробы - вирусы, их природу,химический состав, взаимоотношение с клеткой хозяина, механизмы внутриклеточного паразитизма и т.д. Важнейшими задачами медицинской микробиологии, вирусологии, иммунологии является дальнейшие изучение роли отдельных видов патогенных агентов в этиологии и патогенезе различных заболеваний людей, в том числе в возникновение опухолей, а также механизмов формирования наследственного и приобретенного иммунитета, разработка методов лечения и профилактики инфекционных заболеваний при помощи иммунологических и химиотерапевтических средств и методов специфической диагностики, в том числе экспресс-методов
2) История возникновения и развития микробиологии. Открытие микроорганизмов А. Левенгуком. Морфологический период развития микробиологии. Физиологический период развития микробиологии. Научная деятельность Л. Пастера (изучение природы брожений, инфекционных заболеваний). Исследования Р. Коха в области медицинской микробиологии. Современный период развития микробиологии. Значение молекулярно-генетических и молекулярно-биологических исследований в развитии микробиологиии вирусологии. Использование микроорганизмов в биотехнологии, биогидрометаллургии. Бактериальные биопестициды, биоудобрения, микробная утилизация ТБО и других отходов.
На протяжении тысячелетий человек жил в окружении невидимых существ, бессознательно использовал продукты их жизнедеятельности, основой которых служили процессы молочнокислого, спиртового, уксуснокислого брожений. Страдал от них, когда эти существа были причиной болезни, но не подозревал об их присутствии, так как их размеры много ниже предела видимости человеческого глаза. Предположения о том, что брожение, гниение и заразные (инфекционные) болезни - результат воздействия невидимых существ, были выдвинуты Гиппократом (460-377гг. до н.э.), Лукрецием (96-55 гг. до н.э.), Вергилием (70-19 гг. до н.э.). Врач и астроном Д. Фракастро (1478-1553), А. Кирхер (начало 17 в.) пришли к заключению, что болезни от человека к человеку передаются мельчайшими живыми существами, но доказать не могли.
Возникновение микробиологии как науки стало возможным после изобретения микроскопа. Первым, кто увидел и описал микроорганизмы, был голландский натуралист Антонио Ван Левенгук (1632-1723), который сконструировал прибор (микроскоп), дававший увеличение до 300 раз. В микроскоп он рассматривал воду из пруда, настои, кровь, зубной налет и многое другое. В рассматриваемых объектах он обнаруживал мельчайшие существа, названые им живыми зверьками (анималькулями), которые имели шаровидные, палочковидные и извитые формы. Книга "Тайны природы, открытые А. Левенгуком" (1695) привлекла внимание ученых многих стран и побудила к изучению микроорганизмов. Открытие Левенгука положило начало возникновению и развитию микробиологии. Однако исследования в течение многих десятилетий сводились лишь к описанию различных форм микроорганизмов.
Период с конца 17 века до середины 19 века вошел в историю как описательный, или морфологический, так как роль микроорганизмов в природе, жизни человека оставалось невыясненной, но тем не менее он создал условия для перехода к следующему этапу.
Бурное развитие микробиологии начинается со второй половины 19 века благодаря работам выдающегося французского ученого-химика (1822-1895), который открыл сущность природы брожения и положил начало физиологическому периоду. В то время в науке господствовала теория Ю. Либиха, утверждавшая, что брожение и гниение - результаты окислительных процессов, обусловленных действием ферментов, и представляют собой чисто химическое явление без участия микроорганизмов. Л. Пастер доказал, что причина брожения и гниения - микроорганизмы, вырабатывающие различные ферменты. Каждый бродильный процесс обусловлен жизнедеятельностью специфического возбудителя; гниения вызываются группой гнилостных бактерий и т.д. Изучая масляно-кислое брожение, Пастер установил, что Bac. butyricum развивается при отсутствии кислорода, тем самым открыл явление анаэробиоза.
С именем Л. Пастера связано решение вопроса о самопроизвольном зарождении жизни. Он экспериментально доказал, что при абсолютной стерильности питательных растворов и исключении последующего загрязнения в них невозможно появление микробов и развитие гниения. Жизнь возникает тогда, писал Л. Пастер, когда микроорганизмы в питательные растворы проникают из вне.
В 1865 г. Л. Пастер установил, что порча вина и пива обусловлены попаданием в сусло микроорганизмов или диких дрожжей, и для предупреждения их размножения предложил нагревать вино пиво до 100С. Этот способ получил название пастеризация.
Историческая справедливость требует отметить, что в 18 веке, еще задолго до Л. Пастера выдающийся русский ученый М. Тереховский (1740-1796) применял кипячение как метод стерилизации в своих опытах, поставленных с целью решения вопроса самозарождении. Анализируя условия появления живых организмов в различных настоях, он пришел к выводу, что их образование в средах, подвергнутых кипячению, не происходит. Благодаря этим открытием возникли антисептика и асептика в хирургии.
В 1868 году Л. Пастер установил, что болезнь шелковичных червей пебрину вызывают особые микроорганизмы. Для борьбы с ними, он предложил простой и эффективный метод: всех больных червей (гусениц) - производителей шелка - уничтожать и заменять здоровыми бабочками.
Занимаясь изучением природы заразных болезней, Пастер открыл возбудителя холеры кур, стафилококки, стрептококк, возбудителя рожи свиней, установил этиологию сибирской язвы. Он обнаружил важное свойство патогенных микроорганизмов - способность к ослаблению вирулентности. На этой основе им была разработана стройная теория ослабления (аттенуации) вирулентности микроорганизмов. Пастер успешно использовал ослабленные культуры для прививок против инфекционных болезней. Культуры микроорганизмов с ослабленной вирулентностью были названы вакцинами, а метод прививок - вакцинацией. Л. Пастер предложил методы получения вакцин против холеры кур, сибирской язвы бешенства. С этого времени в микробиологии наступила иммунологическая эра. Основателями иммунологии были И.И. Мечников (1845-1916), Эмиль Беринг (1854-1917) и Пауль Эрлих (1854-1915).
Идея предохранения людей от заразных болезней не была новой. За много лет до работ Пастера английский врач Э. Дженнер (1749-1823) разработал метод предохранительных прививок против оспы. Заражая людей коровьей оспой, он по существу разрешил проблему борьбы с оспой человека. Однако сущность этого метода была разгадана Л. Пастером только через 100 лет.
При изучении сибирской язвы Пастером в результате культивирования сибиреязвенных бацилл при температуре 42,5. С был получен низковерулентный вакцинный штамм.
микробиология пастер микроскоп болезнь
Вершина деятельности Пастера - исследование по борьбе с бешенством. Многочисленные попытки выделить возбудителя на искусственной среде или хотя бы увидеть его под микроскопом оказались безрезультатным. Поэтому в качестве исходного материала, для приготовления вакцины, был использован мозг кроликов, зараженных суспензией из мозга собаки, погибшей от бешенства. Путем многократных пассажей через мозг кролика, был получен возбудитель со стабильными свойствами (virus fixe), который послужил исходным материалом для изготовления антирабических (rabies - бешенство) вакцин. Опыты предохранения собак от заражения бешенством с помощью таких вакцин дали хороший результат. Однако испытать вакцину на человеке Л. Пастер долго не соглашался. Все же он решился вакцинировать ребенка, сильно искусанного бешеной собакой, и тем спас его от смерти.
Успех Л. Пастера стал сенсация. В Париж из разных стран начали прибывать люди, искусанные бешенными животными. Одной из первых стран, где было налажено производство антирабической вакцины по методу Л. Пастера и прививки для предупреждение бешенства, была Россия. В июне 1886 г.И. И. Мечников и Н.Ф. Гамалея организовали в Одессе Пастеровскую станцию.
Идеи Л. Пастера и его учеников (э. Ур, А. Иерсен, Э. Дюкло, Ш. Шамберлан, Г. Рамон Ж. Борде, А. Кальмет и др.), теоретические и практические результаты их исследований приобрели всеобщее признание; благодаря их использованию были открыты и изучены возбудители многих заразных болезней, разработаны средства и методы лечения и профилактики.
Ценный вклад в новую науку - микробиологию наряду с Пастером внес немецкий ученый Роберт Кох (1843-1910). Им разработаны методы микробиологических исследований. Впервые в практики лабораторных исследований были предложены плотные питательные среды мясо-пептонный желатин и мясо - пептонный агар), что позволило выделить и изучить чистые культуры микробов. Кох разработал методы окраски микробов анилиновыми красителями, применил для микроскопии иммерсионную систему и конденсор Аббе, а также микрофотографирование, научно обосновал теорию и практику дезинфекции. Велики его заслуги в изучении микроорганизмов как возбудителей заразных болезней. Кох выявил возбудителя сибирской язвы (1876), туберкулеза (1882), холеры человека (1883)), изобрел туберкулин. Им была создана школа бактериологов, из которой вышли Э. Беринг, Ф. Лефлер, Р. Прффейфер, Г. Гаффки и др.
Отечественные ученые обогатили микробиологию рядом крупнейших открытий. Одним из первых " охотников за микробами" в Европе и России был русский врач Данило Самойлович Вовремя эпидемии чумы в Москве в 1771 г. он пытался найти возбудителя этого заболевания. Обладая качествами бесстрашного исследователя, он заразил себя гноем больных, чтобы доказать возможность предохранения людей от чумы в Таганроге.
На ранних этапах развития микробиологии имели значение работы Л.С. Ценковского, который в 1856 г. опубликовал классический труд "О низших водорослях и инфузориях" Л.С. Ценковский на основе принципа аттенуации микробов, разработанного Л. Пастером, получил свой вариант вакцинного штамма бацилл сибирской язвы. Его вакцины 1 и 2 против сибирской язвы (1883) многие годы использовали в ветеринарной практике.
Велики заслуга в развитие микробиологии гениального русского ученого И. И Мечникова (1845-1916). К числу важнейших достижений в области микробиологии относится его исследования патогенеза холеры человека, сифилиса, туберкулеза, возвратного тифа. Он является основоположником учения о микробном антагонизме, ставшем основной для развития науки об антибиотикотерапии. На принципе антогонизма им была обоснована теория долголетия и предложено для продления человеческой жизни использовать простоквашу, впоследствии названую мечниковской. В 1886 г. он совместно с Н.Ф. Гамеля организовал первую в России Одесскую бактериологическую станцию.
И.И. Мечников создал новое направление в микробиологии - иммунологию - учение о невосприимчивости организма к инфекционным болезням (иммунитет). Им создана фагоцитарная теория иммунитета, раскрыта сущность воспаления как защитной реакцией организма. Немало учеников Мечникова впоследствии стали крупными микробиологами: Н.Ф. Гамалея, А.М. Безредка, Л.А. Тарасевич, Г.Н. Габричевский и д. р.
Велика роль в становлении микробиологии Н, Ф, Гемелеи (1859-1949). Его научные работы посвящены изучению инфекции и иммунитета, изменчивости бактерий, профилактике сыпного тифа, холеры, туберкулеза и других болезней. Гамелия впервые в 1893 г. наблюдал и описал явление спонтанного лизиса бактерий под влиянием неизвестного в то время агента - бактериофага, принимал активное участие в создании первой бактериологической станции в России и ввел в практику прививку против бешенства.
Г.Н. Габричевский (1860-1907) первым начал читать курс бактериологии в Московском университете. В1893 г. он выпустил учебник "Медицинская микробиология", в 1895 г. создал в Москве первый бактериологический институт. С первых дней работы института Г.Н. Габричевский приступил к изготовлению противодифтерийной сыворотки, затем внедрил ее во врачебную практику. Он установил значение гемолитического стрептококка как возбудителя скарлатины, разработал и предложил вакцину, изучил его роль в патологии человека.
Многим обязана микробиология русскому ученому Д.И. Ивановскому (1864-1920), создателю нового направления - вирусологии. В 1892 г. им был открыт возбудитель мозаичной болезни табака, получивший название фильтрующегося вируса.
Основоположник общей и почвенной микробиологии С.Н. Виноградский (1856-1953) разработал накопительные питательные среды, выделил и изучил азотфиксирующие и нитрифицирующие бактерии почвы, установил роль микробов в круговороте азота, углерода, фосфора, железа и серы; впервые доказал существование бактерий, самостоятельно синтезирующих органические вещества, что позволило открыть новый тип питание микробов - аутотрофизм.
Славную страницу в историю ветеринарной микробиологии внесли отечественные микробиологи Е.М. Земмер, И.И. Щукевич, И.М. Садовский, А.В. Конев, А.А. Раевский и многие другие. Крупнейшим вкладом в мировую науку послужило почти одновременно изготовление в 1891г. русскими и О.И. Кальнингом маллеина для аллергического диагностики сапа.
Большой вклад в развитие ветеринарной микробиологии по изучению патогенеза, разработке диагностики и средств специфической профилактики многих инфекционных болезней животных внесли Г.М. Андреевский, П.Н. Андреев, А.М. Владимиров, С. В, Вышелесский, Д.С. Руженцев, М.Г. Тартаковский и многие другие.
Н.А. Михин (1872-1946) - один из основоположников ветеринарной микробиологии в нашей стране - открыл возбудителя лептоспирозакрупного рогатого скота, разработал методику изготовление формул вакцины против сальмонеллеза теляти противосибиреязвенной сыворотки. Он является автором первого в стране учебника "Курс частной микробиологии для ветеринарных врачей и студентов".
С развитием ветеринарной науки росла и совершенствовалась школа ветеринарных микробиологов, давшая нашей стране плеяду ученых-микробиологов (Н.Н. Гинсбург, Я.Е. Коляков, В.В. Кузьмин, И.И. Кулеско, В.Т. Котов, С.Г. Колесов, Я.Р. Коваленко, Н.В. Лихачев, С.Я. Любашенко, С.А. Муромцев, М.Д. Полыковский, И.В. Поддубский, А.А. Поляков, А.Х. Саркисов, П.С. Соломкин, М.К. Юскович, Р.А. Цион, П.А. Триленко и многие другие), внесших значительный вклад в изучение возбудителей инфекционных болезней сельскохозяйственных животных, создание новых и совершенствование известных вакцин, иммунных сывороток и диагностических препаратов, что позволило ликвидировать многие инфекционные болезни и обеспечить эпизоотическое благопалочие в стране.
3) Прокариотные и эукариотные микроорганизмы, основные различия.
Все организмы, имеющие клеточное строение, делятся на две группы: предъядерные (прокариоты) и ядерные (эукариоты).
Клетки прокариот, к которым относятся бактерии, в отличие от эукариот, имеют относительно простое строение. В про-кариотической клетке нет организованного ядра, в ней содержится только одна хромосома, которая не отделена от остальной части клетки мембраной, а лежит непосредственно в цитоплазме. Однако в ней также записана вся наследственная информация бактериальной клетки.
Цитоплазма прокариот по сравнению с цитоплазмой эука-риотических клеток значительно беднее по составу структур. Там находятся многочисленные более мелкие, чем в клетках эукариот, рибосомы. Функциональную роль митохондрий и хло-ропластов в клетках прокариот выполняют специальные, довольно просто организованные мембранные складки.
Клетки прокариот, так же как и эукариотические клетки, покрыты плазматической мембраной, поверх которой располагается клеточная оболочка или слизистая капсула. Несмотря на относительную простоту, прокариоты являются типичными независимыми клетками.
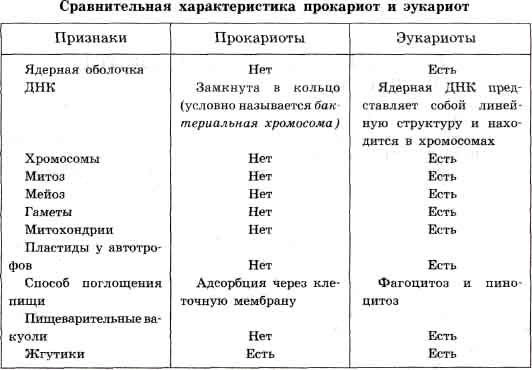
Сравнительная характеристика клеток эукариот. По строению различные эукариотические клетки сходны. Но наряду со сходством между клетками организмов различных царств живой природы имеются заметные отличия. Они касаются как структурных, так и биохимических особенностей.
Для растительной клетки характерно наличие различных пластид, крупной центральной вакуоли, которая иногда отодвигает ядро к периферии, а также расположенной снаружи плазматической мембраны клеточной стенки, состоящей из целлюлозы. В клетках высших растений в клеточном центре отсутствует центриоль, встречающаяся только у водорослей. Резервным питательным углеводом в клетках растений является крахмал.
В клетках представителей царства грибов клеточная стенка обычно состоит из хитина - вещества, из которого построен наружный скелет членистоногих животных. Имеется центральная вакуоль, отсутствуют пластиды. Только у некоторых грибов в клеточном центре встречается центриоль. Запасным углеводом в клетках грибов является гликоген.
В клетках животных отсутствует плотная клеточная стенка, нет пластид. Нет в животной клетке и центральной вакуоли. Центриоль характерна для клеточного центра животных клеток. Резервным углеводом в клетках животных также является гликоген.
4) Морфология прокариот.
Тело прокариот, как правило, состоит из одной клетки. Реже встречаются нитчатые и колониальные формы. Форма клеток бактерий изменчива, однако можно выделить несколько основных морфологических типов:
1. Кокки – шаровидные формы. К коккам относятся: микрококки – одиночные клетки, диплококки – парные кокки; стрептококки – колонии в виде цепочек; стафилококки – гроздевидные колонии; сарцины – колонии кубической формы.
2. Палочки. К палочкам относятся: собственно бактерии (которые, как правило, не образуют споры), а также бациллы и клостридии (которые образуют споры). Споры у бактерий служат не для размножения, а для перенесения неблагоприятных условий – одна клетка образует одну спору. Споры могут образовываться в центральной части клетки или на одном из концов палочки.
3. Извитые формы. К извитым формам относятся одноклеточные бактерии: спириллы (клетки в виде длинной спирали) и вибрионы (клетки, изгиб которых составляет 1/4 спирали).
4. Нитевидные формы. К нитевидным формам относятся как одноклеточные, так и многоклеточные прокариоты. Тело нитевидных прокариот может быть неразветвленным и разветвленным.
Многие прокариоты способны к активному движению, которое, как правило, осуществляется с помощью жгутиков.
Особенности строения прокариотической клетки
В клетках прокариот отсутствуют постоянные двумембранные и одномембранные органоиды: пластиды и митохондрии, эндоплазматическая сеть, аппарат Гольджи и их производные. Их функции выполняют мезосомы – складки плазматической мембраны. У фотоавтотрофных прокариот имеются разнообразные мембранные структуры, на которых протекают реакции фотосинтеза. Иногда их называют бактериальными хроматофорами. Специфическим веществом клеточной стенки прокариот является муреин (у некоторых прокариот муреин отсутствует). По характеру окрашивания клеточной стенки различают грамположительные и грамотрицательные бактерии. Поверх клеточной стенки часто имеется слизистая капсула. Пространство между мембраной и клеточной стенкой служит резервуаром протонов при фотосинтезе и аэробном дыхании.
Генетический аппарат прокариот представлен бактериальными хромосомами и плазмидами. Бактериальная хромосома – это кольцевая молекула ДНК длиной в несколькомиллионов нуклеотидных пар, структура которой стабилизирована молекулами РНК и негистонными белками. Область цитоплазмы, в которой находится бактериальная хромосома, называется нуклеоид. Обычно в бактериальной клетке имеется одна бактериальная хромосома, в которой локализованы основные гены. Однако существуют прокариоты, у которых бактериальная хромосома представлена множеством копий. Плазмиды – это мелкие кольцевые молекулы ДНК, несущие дополнительную генетическую информацию. Некоторые плазмиды участвуют в обмене генетической информацией между разными клетками.
5) Строение, химический состав и функции компонентов прокариотной клетки. Цитоплазма. Рибосомы. Внутрицитоплазматические включения (хлоросомы, фикобилисомы, карбоксисомы, аэросомы, запасные вещества, белковые включения у Bacillusthuringiensis). Внутрицитоплазматические мембраны (фотосинтетические мембраны и др.).
Клеточная стенка
Клеточная стенка -- важный и обязательный структурный элемент подавляющего большинства прокариотных клеток, располагающийся под капсулой или слизистым чехлом или же непосредственно контактирующий с окружающей средой (у клеток, не содержащих этих слоев клеточной оболочки).
На долю клеточной стенки приходится от 5 до 50 % сухих веществ клетки. Клеточная стенка служит механическим барьером между протопластом и внешней средой и придает клеткам определенную, присущую им форму. Концентрация солей в клетке, как правило, намного выше, чем в окружающей среде, и поэтому между ними существует большое различие в осмотическом давлении. Клеточная стенка чисто механически защищает клетку от проникновения в нее избытка воды.
По строению и химическому составу клеточная стенка прокариот резко отличается от таковой эукариотных организмов. В ее состав входят специфические полимерные комплексы, которые не содержатся в других клеточных структурах. Химический состав и строение клеточной стенки постоянны для определенного вида и являются важным диагностическим признаком.
При последующей обработке спиртом в зависимости от строения клеточной стенки судьба комплекса различна. У так называемых грамположительных видов этот комплекс удерживается клеткой, и последние остаются окрашенными, у грамотрицательных видов, наоборот, окрашенный комплекс вымывается из клеток, и они обесцвечиваются. У некоторых эубактерий положительная реакция при окрашивании описанным выше способом свойственна только клеткам, находящимся в стадии активного роста. Выяснено, что окрашенный комплекс образуется на протопласте, но его удерживание клеткой или вымывание из нее при последующей обработке спиртом определяются особенностями строения клеточной стенки.
В состав клеточной стенки эубактерий входят семь различных групп химических веществ, при этом пептидогликан присутствует только в клеточной стенке. У грамположительных 1 эубактерий он составляет основную массу вещества клеточной стенки (от 40 до 90 %), у грамотрицательных -- содержание пептидогликана значительно меньше (1 - 10 %). Клеточная стенка цианобактерий, сходная с таковой грамотрицательных эубактерий, содержит от 20 до 50 % этого гетерополимера.
У грамотрицательных эубактерий обнаружена многослойная клеточная стенка. Внутренний электронно-плотный слой толщиной порядка 2 - 3 нм состоит из пептидогликана. Снаружи к нему прилегает, как правило, волнистый слой (8 - 10 нм), имеющий характерное строение: две электронно-плотные полосы, разделенные электронно-прозрачным промежутком. Такой вид характерен для элементарных мембран. Поэтому трехконтурный внешний компонент клеточной стенки грамотрицательных эубактерий получил название наружной мембраны.
К N-ацетилмурамовой кислоте присоединен короткий пептидный хвост, состоящий из небольшого числа (обычно 4 - 5) аминокислот. У грамположительных эубактерий обнаружено более 100 различных химических типов пептидогликана. Большинство различий относится к пептидной части его молекулы.
Две особенности пептидного хвоста заслуживают внимания: наличие аминокислот в D-форме (неприродная конфигурация) и высокое содержание аминокислот с двумя аминогруппами. Это имеет принципиальное значение для пространственной организации пептидогликана. Обе аминогруппы этих аминокислот могут участвовать в образовании пептидных связей, причем вторые аминогруппы -- в формировании дополнительных пептидных связей между гетерополимерными цепочками.
Жгутики и механизмы движения
На клеточной поверхности многих прокариот имеются структуры, определяющие способность клетки к движению в жидкой среде. Это -- жгутики. Их число, размеры, расположение, как правило, являются признаками, постоянными для определенного вида, и поэтому учитываются при систематике прокариот. Однако накапливаются данные о том, что количество и расположение жгутиков у одного и того же вида могут в значительной степени определяться условиями культивирования и стадией жизненного цикла, и, следовательно, не стоит переоценивать таксономическое значение этого признака.
Если жгутики находятся у полюсов или в полярной области клетки, говорят об их полярном или субполярном расположении, если -- вдоль боковой поверхности, говорят о латеральном расположении.
В зависимости от числа жгутиков и их локализации на поверхности клетки различают монополярные монотрихи (один жгутик прикреплен к одному полюсу клетки; см. рис. 1; 8), монополярные политрихи (пучок жгутиков расположен на одном полюсе клетки), биполярные политрихи (на каждом полюсе -- по пучку жгутиков; см. рис. 1; 17 ) и перитрихи (многочисленные жгутики расположены по всей поверхности клетки или вдоль ее боковой поверхности; см. рис. 1; 18 ). В последнем случае число жгутиков может достигать 1000 на клетку.
Обычная толщина жгутика -- 10 - 20 нм, длина -- от 3 до 15 мкм. У некоторых бактерий длина жгутика может на порядок превышать диаметр клетки.
Ворсинки
К поверхностным структурам бактериальной клетки относятся также ворсинки (фимбрии, пили) (см. рис. 2; 6). Их насчитывается от нескольких единиц до нескольких тысяч на клетку. Эти структуры не имеют отношения к движению бактерий и обнаружены у подвижных и неподвижных форм. Ворсинки построены из одного вида белка -- пилина -- и представляют собой прямые белковые цилиндры, отходящие от поверхности клетки. Они, как правило, тоньше жгутиков (диаметр -- 5 - 10 нм, длина 0,2 - 2,0 мкм), расположены перитрихиально или полярно. Больше всего сведений имеется о ворсинках Е. coli. У этой бактерии описаны ворсинки общего типа и половые.
Ворсинки общего типа придают бактериям свойство гидрофобности, обеспечивают их прикрепление к клеткам растений, грибов и неорганическим частицам, принимают участие в транспорте метаболитов. Через ворсинки в клетку могут проникать вирусы.
Наиболее хорошо изучены половые ворсинки, или F-пили, принимающие участие в половом процессе бактерий. F-пили необходимы клетке-донору для обеспечения контакта между ней и реципиентом и в качестве конъюгационного тоннеля, по которому происходит передача ДНК. Ворсинки нельзя считать обязательной клеточной структурой, так как и без них бактерии хорошо растут и размножаются.
Мембраны
Содержимое клетки отделяется от клеточной стенки цитоплазматической мембраной (ЦПМ) -- обязательным структурным элементом любой клетки, нарушение целостности которого приводит к потере клеткой жизнеспособности. На долю ЦПМ приходится 8 - 15 % сухого вещества клеток. У большинства прокариотных клеток ЦПМ -- единственная мембрана. В клетках фототрофных и ряда хемотрофных прокариот содержатся также мембранные структуры, располагающиеся в цитоплазме и получившие название внутрицитоплазматических мембран. Их происхождение и функции будут рассмотрены ниже.
Химический состав мембран
ЦПМ -- белково-липидный комплекс, в котором белки составляют 50 - 75 %, липиды -- от 15 до 45 %. Кроме того, в составе мембран обнаружено небольшое количество углеводов. Как правило, липиды и белки составляют 95 % и больше вещества мембран.
Главным липидным компонентом бактериальных мембран являются фосфолипиды -- производные 3-фосфоглицерина. Хотя у прокариот найдено множество различных фосфолипидов, набор их в значительной степени родо- и даже видоспецифичен.
Широко представлены в бактериальных мембранах различные гликолипиды. Стерины отсутствуют у подавляющего большинства прокариот, за исключением представителей группы микоплазм и некоторых бактерий. Так, в ЦПМ Acholeplasma содержится 10 - 30 % холестерина, поглощаемого из внешней среды, от общего содержания мембранных липидов. Из других групп липидов в мембранах прокариот обнаружены каротиноиды, хиноны, углеводороды.
Цитозоль и рибосомы
Содержимое клетки, окруженное ЦПМ, называется цитоплазмой. Фракция цитоплазмы, имеющая гомогенную консистенцию и содержащая набор растворимых РНК, ферментных белков, продуктов и субстратов метаболических реакций, получила название цитозоля. Другая часть цитоплазмы представлена разнообразными структурными элементами: внутрицитоплазматическими мембранами (если они есть), генетическим аппаратом, рибосомами и включениями разной химической природы и функционального назначения.
Рибосомы -- место синтеза белка -- рибонуклеопротеиновые частицы размером 15 - 20 нм. Их количество в клетке зависит от интенсивности процессов белкового синтеза и колеблется от 5000 до 90 000. Общая масса рибосом может составлять примерно 1/4 клеточной массы, а количество рибосомальной РНК (рРНК) -- 80 - 85 % всей бактериальной РНК. Отношение рРНК/белок в рибосомах Е. coli составляет 2:1, у других прокариот оно может быть несколько сдвинуто в сторону преобладания белка. Рибосомы прокариот имеют константу седиментации 705, отчего получили название 70S-частиц. Они построены из двух неодинаковых субчастиц: 305- и 50S-субъединиц (Обозначения 30S, 50S, 70S -- константы седиментации, характеризующие скорость, с которой эти частицы осаждаются в центрифуге при определенных стандартных условиях).
30S-частица содержит одну молекулу 16S-рРНК и в большинстве случаев по одной молекуле белка более 20 видов. 50S-субъединица состоит из двух молекул рРНК (235 и 55). В ее состав входят более 30 различных белков, также представленных, как правило, одной копией. Большая часть рибосомальных белков выполняет структурную функцию.
Синтез белка осуществляется агрегатами, состоящими из рибосом, молекул информационной и транспортных РНК и называемыми полирибосомами, или полисомами. Последние могут находиться в цитоплазме или же быть связанными с мембранными структурами.
Генетический аппарат и репликация хромосомы
Строение генетического аппарата прокариот долгое время было предметом жарких дискуссий, суть которых сводилась к тому, есть у них такое же ядро, как у эукариот, или нет. Установлено, что генетический материал прокариотных организмов, как и эукариотных, представлен ДНК, но имеются существенные различия в его структурной организации. У прокариот ДНК представляет собой более или менее компактное образование, занимающее определенную область в цитоплазме и не отделенное от нее мембраной, как это имеет место у эукариот. Чтобы подчеркнуть структурные различия в генетическом аппарате прокариотных и эукариотных клеток, предложено у первых его называть нуклеоидом в отличие от ядра у вторых.
При электронно-микроскопическом наблюдении видно, что нуклеоид прокариот, несмотря на отсутствие ядерной мембраны, довольно четко отграничен от цитоплазмы, занимает в ней, как правило, центральную область и заполнен нитями ДНК диаметром около 2 нм. Не исключено, что на выявляемую в электронном микроскопе организацию прокариотной хромосомы большое влияние оказывают условия фиксации препарата. По имеющимся наблюдениям, в живой клетке нуклеоид занимает больше места в цитоплазме.
Вся генетическая информация прокариот содержится в одной молекуле ДНК, имеющей форму ковалентно замкнутого кольца и получившей название бактериальной хромосомы (В прокариотной клетке ДНК может находиться и вне бактериальной хромосомы -- в плазмидах, но последние не являются обязательными клеточными компонентами).
Длина молекулы в развернутом виде может составлять более 1 мм, т. е. почти в 1000 раз превышать длину бактериальной клетки. Длительное время считали, что в распределении нитей ДНК бактериальной хромосомы не прослеживается никакой закономерности. Однако если исходить из того, что молекула ДНК образует беспорядочный клубок, трудно объяснить процесс репликации и последующее распределение образовавшихся хромосом по дочерним клеткам. Специальные исследования показали, что хромосомы прокариот представляют собой высокоупорядоченную структуру, имеющую константу седиментации 1300 - 2000S для свободной и 3200 - 7000S для связанной с мембраной формы. В том и другом случае часть ДНК в этой структуре представлена системой из 20 - 100 независимо суперспирализованных петель. В обеспечении суперспирализованной организации хромосом участвуют молекулы РНК.
Рост и способы размножения
Под ростом прокариотной клетки понимают согласованное увеличение количества всех химических компонентов, из которых она построена. Рост является результатом множества скоординированных биосинтетических процессов, находящихся под строгим регуляторным контролем, и приводит к увеличению массы (а следовательно, и размеров) клетки. Но рост клетки не беспределен. После достижения определенных (критических) размеров клетка подвергается делению.
Для подавляющего большинства прокариот характерно равновеликое бинарное поперечное деление, приводящее к образованию двух одинаковых дочерних клеток. При таком способе деления имеет место симметрия в отношении продольной и поперечной оси. У большинства грамположительных эубактерий и нитчатых цианобактерий деление происходит путем синтеза поперечной перегородки, идущего от периферии к центру (рис. 18, А).
Так у Bacillus subtilis в середине клетки сначала имеет место кольцевое впячивание ЦПМ, сопровождающееся формированием мезосом разного внешнего вида. Они образуются в месте закладки поперечной перегородки, и предполагается их активное участие в процессах синтеза пептидогликана и других компонентов клеточной стенки. Поперечная перегородка формируется из ЦПМ и пептидогликанового слоя, ее наружные слои синтезируются позднее. Клетки большинства грамотрицательных эубактерий делятся путем перетяжки. У Е. coli на месте деления обнаруживается постепенно увеличивающееся и направленное внутрь искривление ЦПМ и клеточной стенки (рис. 18; 5). Синтез новой клеточной стенки может происходить в нескольких местах или только в зоне формирования поперечной перегородки (рис. 18, А, Б).
Вариантом бинарного деления является почкование, которое можно рассматривать как неравновеликое бинарное деление. При почковании на одном из полюсов материнской клетки образуется маленький вырост (почка), увеличивающийся в процессе роста. Постепенно почка достигает размеров материнской клетки, после чего отделяется от последней. Клеточная стенка почки полностью синтезируется заново (рис. 18, В).
В процессе почкования симметрия наблюдается в отношении только продольной оси. При равновеликом бинарном делении материнская клетка, делясь, дает начало двум дочерним клеткам и сама, таким образом, исчезает. При почковании материнская клетка дает начало дочерней клетке, и между ними можно в большинстве случаев обнаружить морфологические и физиологические различия: есть старая материнская клетка и новая дочерняя. В этом случае можно наблюдать процесс старения.
Так, для некоторых штаммов Rhodomicrobium показано, что материнская клетка способна отпочковывать не более 4 дочерних клеток. Дочерние клетки лучше приспосабливаются к меняющимся условиям. Почкование обнаружено в разных группах прокариот: среди фото- и хемотрофов, осуществляющих авто- и гетеротрофный конструктивный метаболизм. Вероятно, оно в процессе эволюции возникало несколько раз.
Внутрицитоплазматические включения
В цитоплазме прокариот обнаруживаются различные включения. Одни из них следует рассматривать как активно функционирующие структуры, другие -- как продукты клеточного метаболизма, не выделяющиеся наружу, но откладывающиеся внутри клетки. Некоторые цитоплазматические включения имеют явно приспособительное значение. И, наконец, многие из них являются запасными веществами, отложение которых клеткой происходит в условиях избытка питательных веществ в окружающей среде, а потребление наблюдается, когда организм попадает в условия голодания.
К числу внутрицитоплазматических включений, выполняющих определенную функцию в фотосинтезе, относятся хлоросомы зеленых бактерий и фикобилисомы цианобактерий.
В этих структурах локализованы пигменты, поглощающие кванты света и передающие их в реакционные центры, т. е. выполняющие роль антенны. Хлоросомы имеют форму продолговатых пузырьков длиной 90 - 150 и шириной 25 - 70 нм, окруженных однословной электронно-плотной мембраной толщиной 2 - 3 нм, построенной только из белка. Они располагаются в непосредственной близости от ЦПМ, плотно к ней примыкая (см. рис. 2).
В хлоросомах локализованы бактериохлорофиллы с, d или е. Водорастворимые пигменты белковой природы (фикобили-протеины) цианобактерий содержатся в особых структурах -- фикобилисомах, расположенных правильными рядами на внешних поверхностях фотосинтетических мембран и под электронным микроскопом имеющих вид гранул диаметром 28 - 55 нм (см. рис. 2).
В клетках некоторых прокариот из групп фототрофных и хемолитотрофных эубактерий содержатся структуры, имеющие форму многогранника с 4 - 6 сторонами и диаметром 90 - 500 нм, получившие название карбоксисом, или полиэдральных тел (см. рис. 2).
Под электронным микроскопом удалось показать, что они заполнены гранулярным содержимым и окружены однослойной мембраной белковой природы толщиной примерно 3 нм. Карбоксисомы состоят из частиц рибулозодифосфаткарбоксилазы, фермента, катализирующего фиксацию СО2 на рибулозодифосфате в восстановительном пентозофосфатном цикле.
До настоящего времени окончательно не выяснено, в какой форме находится фермент в карбоксисомах: в инертном или функционирующем состоянии. Имеются данные в пользу того, что в активно растущей культуре больше фермента находится в растворимой форме. При переходе в стационарную фазу увеличивается доля рибулозодифосфаткарбоксилазы в составе карбоксисом. Эти данные указывают на возможную роль карбоксисом как структур, обеспечивающих защиту фермента от воздействия внутриклеточными протеазами и, таким образом, его консервирование.
Примером внутрицитоплазматических включений, имеющих приспособительное значение, служат магнитосомы и газовые вакуоли, или аэросомы, обнаруженные у водных прокариот. Газовые вакуоли найдены у представителей, относящихся к 15 таксономическим группам. Это сложно организованные структуры, напоминающие пчелиные соты (см. рис. 2). Состоят из множества регулярно расположенных газовых пузырьков, имеющих форму вытянутого цилиндра с заостренными концами (диаметр 65 115, длина 200 - 1200 нм). Каждый пузырек окружен однослойной белковой мембраной толщиной 2 - 3 нм, построенной из одного или двух видов белковых молекул, и заполнен газом, состав которого идентичен таковому окружающей среды.
Мембрана газовых пузырьков проницаема для газов, но не проницаема для воды. Число газовых пузырьков, составляющих аэросому, у разных видов различно и зависит от внешних условий. Основная функция газовых вакуолей состоит в обеспечении плавучести водных организмов, которые с их помощью могут регулировать глубину, выбирая более благоприятные условия. При увеличении объема и числа газовых пузырьков плотность цитоплазмы уменьшается, и клетки перемещаются в верхние слои воды. Сжатие газовых пузырьков, наоборот, приводит к погружению клеток. За несколькими исключениями, газовые вакуоли присущи безжгутиковым видам. Их, вероятно, можно рассматривать как альтернативу жгутикам для движения в вертикальной плоскости.
Запасные вещества прокариот представлены полисахаридами, липидами, полипептидами, полифосфатами, отложениями серы (см. рис. 2; табл. 3). Из полисахаридов в клетках откладываются гликоген, крахмал и крахмалоподобное вещество -- гранулеза. Последняя -- специфический запасной полисахарид анаэробных споровых бактерий группы клостридиев. Названные полисахариды построены из остатков глюкозы. В неблагоприятных условиях они используются в качестве источника углерода и энергии.
6) Генетический аппарат прокариот. Нуклеоид. Плазмиды. Мигрирующие генетические элементы (транспозоны, IS-элементы).
Основу генома кишечной палочки составляют кольцевые молекулы ДНК: прокариотические хромосомы и плазмиды.
Множество молекул ДНК образует две взаимосвязанные подсистемы: хромосомную и плазмидную.
Хромосомная подсистема прокариотического генома
Основу хромосомной подсистемы прокариотического генома составляет прокариотическая (бактериальная) хромосома (генофор), входящая в состав нуклеоида – ядерноподобной структуры. Нуклеоид по морфологии напоминает соцветие цветной капусты и занимает примерно 30% объема цитоплазмы.
Бактериальная хромосома представляет собой кольцевую двуспиральную правозакрученную молекулу ДНК, которая свернута во вторичную спираль. Вторичная структура хромосомы поддерживается с помощью гистоноподобных (основных) белков и РНК. Точка прикрепления бактериальной хромосомы к мезосоме (складке плазмалеммы) является точкой начала репликации ДНК (эта точка носит название сайта OriC). Бактериальная хромосома удваивается перед делением клетки. Репликация ДНК идет в две стороны от сайта OriC и завершается в точке TerC. Молекулы ДНК, способные себя воспроизводить путем репликации, называются репликоны.
В прокариотических хромосомах число сайтов OriC может быть увеличено, например, у сенной палочки Bacillus subtilis их не менее двух.
Длина прокариотической хромосомы составляет несколько миллионов нуклеотидных пар (мпн); например, минимальная длина ДНК прокариотической хромосомы E. coli штамма MG1655 составляет 4639221 пн (физическая длина около 1,5 мм).
У разных прокариот размер генома изменяется от до 0,5 до 6 мпн:
Примерно 11% ДНК прокариотической хромосомы E. coli представлено «некодирующими» (нетранскрибируемыми) последовательностями. Остальные 89% ДНК транскрибируются или могут транскрибироваться с образованием РНК. Примерно 75% транскрипционных единиц ДНК (участок ДНК от промотора до терминатора) содержит 1 ген (обычно это гены «домашнего хозяйства», то есть гены, необходимые для поддержания жизнедеятельности клетки), остальные 25% представляют собой опероны (геном E. coli содержит 600…700 оперонов).
У типичных прокариот (например, у кишечной палочки) в неделящейся клетке имеется одна бактериальная хромосома. Поэтому прокариоты в целом являются гаплоидами (гаплобионтами).
У гаплоидов каждый ген представлен одним аллелем, поэтому в целом к прокариотам неприменимы понятия «доминантности» и «рецессивности»: любой аллель проявляется в фенотипе, если данный ген экспрессируется (наблюдается моноаллельное наследование).
В лаг-фазе в клетке имеется одна бактериальная хромосома, но в фазе экспоненциального роста ДНК реплицируется быстрее, чем происходит деление клетки; тогда число бактериальных хромосом на клетку увеличивается до 2...4...8. Такое состояние генетического аппарата называется полигаплоидностью.
При делении клетки сестринские копии бактериальной хромосомы равномерно распределяются по дочерним клеткам с помощью мезосомы.
Механизм сегрегации хромосомной подсистемы прокариотического генома обеспечивает полное сохранение объема и качества генетической информации, содержащейся в бактериальной хромосоме. В результате происходит прямое наследование признаков
Например, если в популяции нормальных прокариот (прототрофных, «дикого типа») в одной из клеток возникает мутация, определяющая неспособность синтезировать аминокислоту лейцин, то все потомство (клон, штамм) этой клетки не может существовать на среде, лишенной лейцина (сохраняет ауксотрофность по лейцину).
Из генетически гетерогенной популяции прокариот возможно выделение штаммов (клонов, генетически однородных чистых линий), сохраняющих гаплотип бактериальной хромосомы исходной клетки. В чистых линиях прокариот рекомбинация не происходит. Поэтому невозможно появление новых гаплотипов, новых сочетаний признаков. Например, существуют устойчивые двойные ауксотрофы по биотину и метионину.
В некоторых случаях один и тот же ген прокариотической хромосомы может быть представлен двумя копиями. Такие клетки (гетерогеноты) могут нести доминантные и рецессивные аллели одного гена. Тогда наблюдается диаллельное наследование, например, нормальный аллель прототрофности по лейцину доминирует над мутантным аллелем ауксотрофности.
Плазмидная подсистема прокариотического генома
Кроме бактериальной хромосомы в состав генома прокариот входят плазмиды – кольцевые молекулы ДНК длиной в тысячи п.н. Плазмиды такого размера содержат несколько десятков генов. Обычно это «гены роскоши», обеспечивающие устойчивость к антибиотикам, тяжелым металлам, кодирующие специфические токсины, а также гены конъюгации и обмена генетическим материалом с другими особями. Известны также мелкие плазмиды длиной 2...3 тпн, кодирующие не более 2 белков. У многих бактерий открыты мегаплазмиды длиной порядка миллиона пн, то есть немногим меньше бактериальной хромосомы. Существуют плазмиды, представленные одной копией – они реплицируются синхронно с ДНК бактериальной хромосомы. Другие плазмиды могут быть представлены многими копиями, и их репликация происходит независимо от репликации бактериальной хромосомы. Репликация свободных плазмид часто протекает по принципу «катящегося кольца» – с одной кольцевой матрицы ДНК считывается «бесконечная» копия.
Репликация плазмид может быть синхронизирована с репликацией бактериальной хромосомы, но может быть и независимой. Соответственно, распределение плазмид по дочерним клеткам может быть точным или статистическим. Точная сегрегация характерна для крупных малокопийных плазмид, а статистическая сегрегация – для мелких мультикопийных. В последнем случае одна дочерняя клетка получает избыточную (дублированную) генетическую информацию, а другая клетка может вообще утратить некоторые плазмидные гены
Единство хромосомной и плазмидной подсистем прокариотического генома
Некоторые плазмиды могут находиться в автономном и в интегрированном состоянии. В последнем случае плазмида включается в состав бактериальной хромосомы в определенных точках attB. Таким образом, одна и та же плазмида может включаться в состав хромосомы и может вырезаться из нее.
Это обеспечивает обмен генетической информацией между разными подсистемами прокариотического генома: хромосомной и плазмидной.
7) Цитоплазматическая мембрана прокариот, химический состав, структура, функции. Механизмы мембранного транспорта
Клеточная стенка
Клеточная стенка — важный и обязательный структурный элемент подавляющего большинства прокариотных клеток, располагающийся под капсулой или слизистым чехлом или же непосредственно контактирующий с окружающей средой (у клеток, не содержащих этих слоев клеточной оболочки). На долю клеточной стенки приходится от 5 до 50% сухих веществ клетки. Клеточная стенка служит механическим барьером между протопластом и внешней средой и придает клеткам определенную, присущую им форму. Концентрация солей в клетке, как правило, намного выше, чем в окружающей среде, и поэтому между ними существует большое различие в осмотическом давлении. Клеточная стенка чисто механически защищает клетку от проникновения в нее избытка воды.
По строению и химическому составу клеточная стенка прокариот резко отличается от таковой эукариотных организмов. В ее состав входят специфические полимерные комплексы, которые не содержатся в других клеточных структурах. Химический состав и строение клеточной стенки постоянны для определенного вида и являются важным диагностическим признаком. В зависимости от строения клеточной стенки прокариоты, относящиеся к эубактериям, делятся на две большие группы. Было обнаружено, что если фиксированные клетки эубактерий обработать сначала кристаллическим фиолетовым, а затем йодом, образуется окрашенный комплекс. При последующей обработке спиртом в зависимости от строения клеточной стенки судьба комплекса различна: у так называемых грамположительных видов этот комплекс удерживается клеткой, и последние остаются окрашенными, у грамотрицательных видов, наоборот, окрашенный комплекс вымывается из клеток, и они обесцвечиваются6. У некоторых эубактерий положительная реакция при окрашивании описанным выше способом свойственна только клеткам, находящимся в стадии активного роста. Выяснено, что окрашенный комплекс образуется на протопласте, но его удерживание клеткой или вымывание из нее при последующей обработке спиртом определяются особенностями строения клеточной стенки.
Клеточные стенки грамположительных и грамотрицательных эубактерий резко различаются как по химическому составу (табл. 3), так и по ультраструктуре (рис. 5).
В состав клеточной стенки эубактерий входят семь различных групп химических веществ, при этом пептидогликан присутствует только в клеточной стенке. У грамположительных1 эубактерий он составляет основную массу вещества клеточной стенки (от 40 до 90%), у грамотрицательных — содержание пептидогликана значительно меньше (1—10%). Клеточная стенка цианобактерий, сходная с таковой грамотрицательных эубактерий, содержит от 20 до 50% этого гетерополимера.
1 Этот способ был впервые предложен в 1884 г. датским ученым X. Грамом (Ch. Gram), занимавшимся окрашиванием тканей. Позднее он был использован для бактерий.
Под электронным микроскопом клеточная стенка грамположительных эубактерий выглядит как гомогенный электронно-плотный слой, толщина которого колеблется для разных видов от 20 до 80 нм. У грамотрицательных эубактерий обнаружена многослойная клеточная стенка. Внутренний электронно-плотный слой толщиной порядка 2—3 нм состоит из пептидогликана. Снаружи к нему прилегает, как правило, волнистый слой (8—10 нм), имеющий характерное строение: две электронно-плотные полосы, разделенные электронно-прозрачным промежутком. Такой вид характерен для элементарных мембран. Поэтому трехконтурный внешний компонент клеточной стенки грамотрицательных эубактерий получил название наружной мембраны.
Клеточная стенка грамположительных эубактерий плотно прилегает к ЦПМ, в отличие от клеточной стенки грамотрицательных видов, компоненты которой (пептидогликановый слой и наружная мембрана) разделены электронно-прозрачным промежутком и четко отделены аналогичным образом от ЦПМ. Пространство между цитоплазматической: и наружной мембранами получило название периплазматического. Оно, как можно видеть из строения клеточных стенок обеих групп эубактерий, характерно только для грамотрицательных форм.
Клеточная стенка грамположительных эубактерий. Основную массу клеточной стенки грамположительных эубактерий составляет специфический гетерополимер — пептидогликан. Полисахаридный остов молекулы построен из чередующихся остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных между собой посредством) b-1,4-гликозидных связей (рис. 6). К N-ацетилмурамовой кислоте присоединен короткий пептидный хвост, состоящий из небольшого числа (обычно 4—5) аминокислот. У грамположительных эубактерий обнаружено более 100 различных химических типов пептидогликана. Большинство различий относится к пептидной части его молекулы.
Пептидогликан, окружающий протопласт грамположительных эубактерий, — это по существу одна гигантская молекула, "сшитая" с помощью гликозидных и пептидных связей. Именно последние обеспечивают ей трехмерную пространственную организацию.
Кроме пептидогликана в состав клеточных стенок грамположительных эубактерий входит другой уникальный класс химических соединений — тейхоевые кислоты, представляющие собой полимеры, построенные на основе рибита (пятиатомного спирта) или глицерина (трехатомного спирта), остатки которых соединены между собой фосфодиэфирными связями.Некоторые свободные гидроксильные группы в молекулах спиртов могут быть замещены остатками D-аланина, глюкозы, N-ацетилглюкозамина и некоторых других сахаров. Тейхоевые кислоты ковалентно могут соединяться с N-ацетилмурамовой кислотой. Поскольку это длинные линейные молекулы, они могут пронизывать весь пептидогликановый слой, достигая внешней поверхности клеточной стенки. В этом случае, вероятно, они являются основными антигенами грамположительных эубактерий. Остающиеся свободные гидроксилы фосфорной кислоты придают тейхоевой кислоте свойства полианиона. Как полианионы тейхоевые кислоты определяют поверхностный заряд клетки. Сахарные компоненты тейхоевых кислот входят в состав рецепторов для некоторых бактериофагов и определяют возможность адсорбции фага на клеточной поверхности.
8) Клеточная стенка прокариот. Химический состав и структура клеточной стенки.Грам(+) и Грам (-) бактерий. Функции клеточной стенки прокариот
Смотри №5 и №7
9) Капсулы, слизистые слои и чехлы. Химический состав, структура, функции.Жгутиковый аппарат бактерий. Строение, химический состав, расположение жгутиков. Механизм движения. Микроворсинки: обыкновенные пили, F-пили. Химический состав, строение, функции
Смотри №5
10) Основные типы движения прокариот (плавание, «роение», скольжение, подтягивающее движение и др.). Таксисы у прокариот.
Таксис - направленное перемещение (низших) организмов, отдельных клеток и их органелл под влиянием односторонне действующего стимула. Различают: - положительные таксисы, направленные к источнику воздействия; и - отрицательные таксисы, направленные от источника воздействия.
11) Морфологически дифференцированные клетки прокариот. Эндоспоры, цисты, акинеты, экзоспоры, L-формы. Гормогонии, баеоцисты, гетероцисты, бактероиды.
Покоящиеся формы. Цисты, акинеты цианобактерий, экзоспоры бактерий, экзо- и эндоспоры актиномицетов, эндоспоры грамположительных бактерий. Закономерности формирования эндоспор, строение, химический состав. Устойчивость спор к экстремальным воздействиям, продолжительность жизни спор. Образование специализированных клеток (гетероцисты цианобактерий, бактероиды клубеньковых бактерий). Морфологически дифференцированные клетки, служащие для размножения (гормогонии и баеоцисты цианобактерий).
12) Эндоспоры Грам (+) бактерий, образование, химический состав, строение, свойства
Эндоспоры имеют плотную оболочку, содержащую дипиколинат кальция
13) Размножение бактерий. Способы размножения (бинарное деление, почкование, множественное деление). Фазы амитоза.
Некоторые бактерии не имеют полового процесса и размножаются лишь равновелики бинарным поперечным делением или почкованием. Для одной группы одноклеточных цианобактерий описано множественное деление (ряд быстрых последовательных бинарных делений, приводящий к образованию от 4 до 1024 новых клеток). Для обеспечения необходимой для эволюции и приспособления к изменчивой окружающей среде пластичности генотипа у них существуют иные механизмы.
При делении большинство грамположительных бактерий и нитчатых цианобактерий синтезируют поперечную перегородку от периферии к центру при участии мезосом. Грамотрицательные бактерии делятся путём перетяжки: на месте деления обнаруживается постепенно увеличивающееся искривление ЦПМ и клеточной стенки внутрь. При почковании на одном из полюсов материнской клетки формируется и растёт почка, материнская клетка проявляет признаки старения и обычно не может дать более 4 дочерних. Почкование имеется у разных групп бактерий и, предположительно, возникало несколько раз в процессе эволюции.
У других бактерий кроме размножения наблюдается половой процесс, но в самой примитивной форме. Половой процесс бактерий отличается от полового процесса эукариот тем, что у бактерий не образуются гаметы и не происходит слияния клеток. Однако главнейшее событие полового процесса, а именно обмен генетическим материалом, происходит и в этом случае. Этот называется генетической рекомбинацией. Часть ДНК (очень редко вся ДНК) клетки-донора переносится в клетку-реципиент, ДНК которой генетически отличается от ДНК донора. При этом перенесённая ДНК замещает часть ДНК реципиента. В процессе замещения ДНК участвуют ферменты, расщепляющие и вновь соединяющие цепи ДНК. При этом образуется ДНК, которая содержит гены обеих родительских клеток. Такую ДНК называют рекомбинантной. У потомства или рекомбинантов, наблюдается заметное разнообразие признаков, вызванное смещением генов. Такое разнообразие признаков очень важно для эволюции и является главным преимуществом полового процесса.
Известны 3 способа получения рекомбинантов. Это — в порядке их открытия — трансформация, конъюгация и трансдукция.
14) Рост клеток и рост популяции бактерий. Параметры микробного роста: время генерации, удельная скорость роста. Рост бактерий в периодической культуре. Кривая экспоненциального роста. Непрерывное культивирование. Рост бактерий в хемостате. Уравнение Моно; кривая насыщения.
Жизнедеятельность бактерий характеризуется ростом — формированием структурно-функциональных компонентов клетки и увеличением самой бактериальной клетки, а также размножением — самовоспроизведением, приводящим к увеличению количества бактериальных клеток в популяции.
Бактерии размножаются путем бинарного деления пополам, реже путем почкования. Актиномицеты, как и грибы, могут размножаться спорами. Актиномицеты, являясь ветвящимися бактериями, размножаются путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные — путем перетяжки, в результате образования гантелевид-ных фигур, из которых образуются две одинаковые клетки.
Делению клеток предшествует репликация бактериальной хромосомы по полуконсервативному типу (двуспиральная цепь ДНК раскрывается и каждая нить достраивается комплементарной нитью), приводящая к удвоению молекул ДНК бактериального ядра — нуклеоида.
Репликация ДНК происходит в три этапа: инициация, элонгация, или рост цепи, и терминация.
Размножение бактерий в жидкой питательной среде. Бактерии, засеянные в определенный, не изменяющийся объем питательной среды, размножаясь, потребляют питательные элементы, что приводит в дальнейшем к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим культивированием, а культуру — периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура — непрерывной.
При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры. Рост периодической культуры бактерий, выращиваемых на жидкой питательной среде, подразделяют на несколько фаз, или периодов:1. лаг-фаза;2. фаза логарифмического роста; 3. фаза стационарного роста, или максимальной концентрациибактерий; 4. фаза гибели бактерий.
Лаг-фаза — период между посевом бактерий и началом размножения. Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий. Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень Завершает процесс роста бактерий фаза гибели, характеризующаяся отмиранием бактерий в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Размножение бактерий на плотной питательной среде. Бактерии, растущие на плотных питательных средах, образуют изолированные колонии округлой формы с ровными или неровными краями (S- и R-формы), различной консистенции и цвета, зависящего от пигмента бактерий.
Многие пигменты обладают антимикробным, антибиотикоподобным действием.
15) Отношение прокариот к О2 (облигатные аэробы, микроаэрофилы, факультативные анаэробы, облигатные анаэробы, аэротолерантные анаэробы
Кислород является обязательным химическим компонентом любой клетки. Подавляющее большинство организмов удовлетворяет свои потребности в этом элементе, используя обе формы кислорода. При выращивании Pseudomonas в присутствии 18О2 и Н218О источником приблизительно 10% кислорода, входящего в состав клеточного материала, служил газообразный кислород, 50-60% клеточного кислорода происходило из воды. Остальной кислород в клетку поставляли органические и неорганические компоненты питательной среды (глюкоза, фосфаты, нитраты, сульфаты и др.).
Среди прокариот существуют значительные различия в отношении к молекулярному кислороду. По этому признаку они могут быть разделены на несколько групп Прокариоты, для роста которых О2 необходим, называют облигатными (обязательными) аэробами. К ним относится большинство прокариотных организмов. Среди облигатных аэробов обнаружены существенные различия в отношении к уровню молекулярного кислорода в среде. Некоторые представители этой группы не способны к росту при концентрации О2, равной атмосферной, но могут расти, если содержание О2 в окружающей среде будет значительно ниже (порядка 2%). Такие облигатно аэробные прокариоты получили название микроаэрофилов .
Потребность прокариот в низкой концентрации О2 в окружающей среде связана с их метаболическими особенностями. Многие аэробные азотфиксирующие бактерии могут расти в среде с молекулярным азотом только при концентрации О2 ниже 2%, т.е. как микроаэрофилы, а в присутствии связанного азота, например аммонийного, - на воздухе. Это объясняется ингибирующим действием молекулярного кислорода на активность нитрогеназы - ферментного комплекса, ответственного за фиксацию N2.
Аналогичная картина обнаружена у многих водородокисляющих бактерий. На среде с органическими соединениями в качестве источника энергии они хорошо растут при атмосферном содержании О2. Если источником энергии является окисление молекулярного водорода, эти же бактерии для роста требуют низкой концентрации О2. Последнее связывают с инактивацией молекулярным кислородом гидрогеназы - фермента, катализирующего использование Н2.
Наконец, среди облигатных аэробов существуют значительные различия в устойчивости к высоким уровням О2 в среде. 100%-й молекулярный кислород подавляет рост всех облигатных аэробов. Многие аэробные бактерии могут формировать колонии на поверхности твердой питательной среды в атмосфере, содержащей 40% О2, но рост их прекращается, когда содержание О2 в атмосфере повышается до 50%.
Известны прокариоты, для метаболизма которых О2 не нужен, т. е. энергетические и конструктивные процессы у них происходят без участия молекулярного кислорода. Такие организмы получили название облигатных анаэробов . К ним относятся метанобразующие архебактерии, сульфатвосстанавливающие, маслянокислые и некоторые другие эубактерии . До сравнительно недавнего времени считали, что облигатные анаэробы могут получать энергию только в процессе брожения. В настоящее время известно много облигатно анаэробных прокариот, которые произошли от аэробов в результате вторичного приспособления к анаэробным условиям, приведшего к потере способности использовать О2 в качестве конечного акцептора электронов в процессе дыхания. Такие облигатные анаэробы получают энергию в процессах анаэробного дыхания, т.е. переноса электронов по цепи переносчиков на СО2, SO4--, фумарат и другие акцепторы.
В ряду облигатно анаэробных прокариот, не включающих O2 в метаболические реакции, существует широкий спектр степени устойчивости к молекулярному кислороду, находящемуся во внешней среде. Многие из облигатных анаэробов не выносят присутствия даже незначительных количеств молекулярного кислорода в среде и быстро погибают. Такие организмы называют строгими анаэробами . К числу строгих анаэробов относятся представители родов Bacteroides, Fusobacterium , Butyrivibrio , Methanobacterium и др.
Маслянокислые бактерии относятся также к группе облигатных анаэробов, но среди них есть виды, умеренно ( Clostridium tetani , Сlostridium carnis , Сlostridium tertium, Сlostridium sporogenes ) или достаточно высоко ( Сlostridium perfringens , Сlostridium acetobutylicum ) толерантные к О2.
Наконец, молочнокислые бактерии, обладающие метаболизмом только анаэробного типа, могут расти в присутствии воздуха и выделены в отдельную группу аэротолерантных анаэробов . (Некоторые авторы относят молочнокислые бактерии рода Lactobacillus к микроаэрофилам на том основании, что в их клетках содержатся флавопротеины , катализирующие перенос электронов с НАД*Н2 на О2. Однако этот процесс не связан с получением клеткой энергии).
Хотя облигатно анаэробные бактерии в целом очень чувствительны к О2, они могут в природе находиться в аэробных зонах. Широкое распространение представителей рода Clostridium в местах с высоким парциальным давлением О2 объясняется наличием у них эндоспор, не чувствительных к молекулярному кислороду. Однако и многие не образующие спор строго анаэробные прокариоты обнаружены в природе в местах, где наблюдается активное развитие облигатных аэробов. Вероятно, совместное развитие с облигатными аэробами, активно потребляющими молекулярный кислород, приводящее к образованию зон с низкой концентрацией 02, создает возможности и для развития строго анаэробных видов.
Описаны прокариотные организмы, которые могут расти как в аэробных, так и в анаэробных условиях. Изучение этого явления показало, что природа его различна. Бактерии, не нуждающиеся в О2 (последний не участвует в осуществляемых ими метаболических реакциях), но способные расти в его присутствии, являются по типу осуществляемого ими метаболизма облигатными анаэробами , устойчивыми к О2 внешней среды. Примером таких организмов служат молочнокислые бактерии. Многие прокариоты, относящиеся к этой же группе, приспособились в зависимости от наличия или отсутствия О2 в среде переключаться с одного метаболического пути на другой, например с дыхания на брожение, и наоборот. Такие организмы получили название факультативных анаэробов, или факультативных аэробов . Представителями этой физиологической группы прокариот являются энтеробактерии . В аэробных условиях они получают энергию в процессе дыхания. (Среди факультативных анаэробов в условиях осуществления ими метаболизма аэробного типа также могут быть микроаэрофилы ). В анаэробных условиях источником энергии для них служат процессы брожения или анаэробного дыхания.
Потребность в О2 у аэробов определяется его участием в энергетических и конструктивных процессах. В первом случае О2 служит обязательным конечным акцептором электронов, во втором - участвует в реакциях (или единственной реакции) на пути многоступенчатого преобразования клеточных метаболитов или экзогенных субстратов. У облигатных аэробов большая часть О2 используется в качестве конечного акцептора электронов в реакциях, катализируемых цитохромоксидазами. Меньшая часть включается в молекулы с помощью ферментов, получивших общее название оксигеназ. В клетках факультативных анаэробов также содержатся цитохромоксидазы. У облигатных анаэробов нет ферментов, катализирующих взаимодействие с О2.
16) Влияние температуры на жизнедеятельность микроорганизмов. Температурный диапазон. Психрофилы, мезофилы, термофилы и их распространение в природе. Механизмы психро- и термофилии. Использование высоких температур для инактивации микроорганизмов. Использование низких температур для хранения микроорганизмов.
Экстремальные термофилы и гипертермофилы
Обитают в потоках гидротерамльной воды и газа в районах вулканической деятельности (Исландия, Камчатка и т.д.), а также в глубоководных морских источниках (гидротермах).
Отношение к О2. Аэробы, строгие или фаультативные анаэробы.
Метаболизм. Хемоавтотрофы или хемогетеротрофы, могут быть литотрофами (если окисляют Н2) или органотрофами (если окисляют пептон). Являются сульфидогенами, так как участвуют в обмене серы. В анаэробных условиях восстанавливают молекулярную серу до H2S. В аэробных условиях окисляют H2S до молекулярной серы или H2SO4.
Представители: Род Sulfolobus – распространены в горячих кислых источниках Температурный диапазон +60 - +90 °С.
Гипертермофилы: Наиболее термоустойчивыми на сегодняшний день являются архебактерии-гипретермофилы р. Pyrococcus («неистовые огненные шарики») и Pyrodictium (огненная сеть). P. furiosus (морская архебактерия, обитает в геотермальных морских осадках) t диапазон 70-103С, opt t 100С. Pyrodictium еще более термоустойчива t диапазон 80-110С, opt t 105 С (обитает в подводных гидротермах).
Психрофи́лы или Криофилы — организмы, нормально существующие и размножающиеся при относительно низких температурах (обычно не выше 10 °C).
Мезофилы — организмы лучше всего растущие при умеренной температуре, в не слишком горячих, но и не очень холодных условиях, обычно между 20 и 45 °C. Термин употребляется главным образом в отношении микроорганизмов.
17) Влияние рН среды на жизнедеятельность микроорганизмов. Ацидофилы, нейтрофилы, алкалофилы, их распространение в природе. Механизмы рН-гомеостаза.
Алкалофилы-щлочная среда, ацидофилы-кислая (желудок человека)
18) Влияние водной активности на микроорганизмы. Осмофилы и галофилы. Механизмы приспособления к высокому осмотическому состоянию среды. Матричный водный стресс. Ксерофильные микроорганизмы. Механизмы ксерофилии.
Осмофилы (от осмос и др.-греч. φιλέω — люблю) — тип экстремофилов: организмы, способные существовать в субстрате с высоким осмотическим давлением.
Однако организмы-осмофилы приурочены к определённому местообитанию не столько в зависимости от осмотического давления, сколько от химического состава среды.
Истинных осмофилов — организмов, одинаково хорошо растущих в изоосмотических растворах различного химического состава, — не существует.
В зависимости от повышенного содержания в субстрате какого-либо иона и потребности в нём организмов их принято делить на:
натриофилы
калиофилы
кальцефилы,
магниофилы,
фторофилы,
селенофилы и т. д.
В данных случаях осмотическое давление является производной величиной от химического состава среды. При замене субстрата или изменении его ионного состава при сохранении на осмотического давления обычно приводит к гибели организма.
Галофилы (от ἅλς — соль и φιλέω — люблю) — тип экстремофилов, организмы, обитающие в условиях высокой солёности — в морях, солёных озерах, засоленных почвах и т. п. Галофилы способны поддерживать в жидкостях тела относительно постоянную концентрацию осмотически активных веществ, более низкую, чем в окружающей их морской воде с помощью осморегуляции.
Галофильные микроорганизмы обитают в солёных водоёмах и засоленных почвах. Высокие концентрации хлорида натрия необходимы им для поддержания структурной целостности цитоплазматической мембраны и функционирования связанных с ней ферментных систем. При удалении из солёной среды, их клеточная стенка растворяется, а цитоплазматическая мембрана распадается на мелкие фрагменты.
Галофильные микроорганизмы способны расти в средах с высокой концентрацией хлорида натрия до 32 %. Экстремальные галофилы способны развиваться в средах, содержащих до 15—32 % хлорида натрия (бактерии родов Halobacterium, Halococcus), умеренные галофилы растут на средах с 5—20 % хлорида натрия (бактерии родов Paracoccus, Halodenitricant, Pseudomonas, Vibrion и некоторые микроводоросли), слабогалофильные микроорганизмы лучше растут в средах с 2—5 % хлорида натрия (морские микроорганизмы).
Цитоплазматическая мембрана галофильных микроорганизмов имеет характерные черты строения — она состоит из около 1/3 липидов и 2/3 различных белков, включая обычные наборы флавопротеинов и цитохромов. Основная масса липидов экстремальных галофилов отличается тем, что в их молекуле глицерин связан с фитанолом а не с остатками жирных кислот. Также клеточные мембраны экстремальных галофилов содержат много каротиноидных пигментов, основной из которых — бактериоруберин), обусловливающих окраску колоний от розового до красного цвета и красно-оранжевого цветов, что имеет для галофилов важное значение как средство защиты против избыточной радиации, так как для мест их обитания характерна высокая освещенность.
19) Влияние тяжелых металлов на микроорганизмы. Эффект Арндт-Шульца.
Известно, что микроорганизмы, в том числе дрожжи, способны извлекать из среды катионы тяжелых металлов
В 1888 г. появилась работа Шульца о действии ядов на дрожжи, где автор приводит экспериментальные подтверждения своим положениям и вместе с тем дает последним более общую формулировку, согласно к-рой возбуждающее действие всякого раздражения на жизненную деятельность любой клетки обратно пропорционально силе раздражения. Последующие исследования показали, что А.-Ш. закон применим не только к биологии, где имеет очень широкое приложение, но ему подчинен также ряд физ.-хим. коллоидных про – цессов, как, например, коагуляция желатины при различных условиях, набухание ее, действие катализаторов на каталитические и ферментативные процессы и пр. В виду того, что клетки представляют весьма сложные коллоидные системы, жизненные проявления к-рых зависят от происходящих в них физ.-хим. изменений, следует признать, что А.-III. з. касается самых основ жизненного процесса.
20) Влияние гидростатического давления на микроорганизмы. Барофильные и баротолерантные микроорганизмы. Механизмы барофилии
Бактерии относительно мало чувствительны к изменению гидростатического давления. Повышение давления до некоторого предела не сказывается на скорости роста обычных наземных бактерий, но в конце концов начинает препятствовать нормальному росту и делению. Некоторые виды бактерий выдерживают давление до 3 000 – 5 000 атм, а бактериальные споры - даже 20 000 атм. В условиях глубокого вакуума субстрат высыхает и жизнь невозможна.
Барофильные-размножаются только при высоком давлении
Баротолерантные бактерии (от греч. baros — тяжесть и лат. tolerans, родительный падеж tolerantis — выдерживающий), способные расти и размножаться как в условиях нормального атмосферного давления, так и при давлении в несколько сот атм
21) Влияние излучений на микроорганизмы. Фотосинтетически активная радиация для разных групп фототрофов. Влияние видимого и инфракрасного излучения на микроорганизмы. УФ-излучение, ионизирующее излучение. Механизмы радиоустойчивости.
Солнечный свет губительно действует на микроорганизмы, исключением являются фототрофные виды. Наибольший микробицидный эффект оказывает коротковолновые УФ-лучи. Энергию излучения используют для дезинфекции, а также для стерилизации термолабильных материалов. УФ-лучи (в первую очередь коротковолновые, т.е. с длиной волны 250-270 нм) действуют на нуклеиновые кислоты. Микробицидное действие основано на разрыве водородных связей и образовании в молекуле ДНК димеров тимидина, приводящем к появлению нежизнеспособных мутантов. Применение УФ-излучения для стерилизации ограничено его низкой проницаемостью и высокой поглотительной активностью воды и стекла. Рентгеновское и g-излучение в больших дозах также вызывает гибель микробов. Облучение вызывает образование свободных радикалов, разрушающих нуклеиновые кислоты и белки с последующей гибелью микробных клеток. Применяют для стерилизации бактериологических препаратов, изделий из пластмасс. Микроволновое излучение применяют для быстрой повторной стерилизации длительно хранящихся сред. Стерилизующий эффект достигается быстрым подъемом температуры.
22) Химический состав прокариотной клетки. Пищевые потребности прокариот. Источники углерода. Автотрофы и гетеротрофы. Сапрофиты и паразиты. Олиготрофы и копиотрофы. Источники азота, серы, фосфора. Необходимость ионов металлов. Потребности в факторах роста. Ауксотрфы и прототрофы. Гидролитики, группы гидролитиков. Диссиптрофы. Газотрофы.
Химический состав клеток в принципе одинаков у всех организмов. Клетки прокариот содержат от 70 до 90% воды. Основную массу сухих веществ, на долю которых приходятся остальные 10-30%, составляют белки, нуклеиновые кислоты , липиды и полисахариды . Несколько процентов сухого вещества клеток приходится на низкомолекулярные органические вещества и соли ( табл. 9).
Макромолекулы, составляющие основную массу сухих веществ клетки, - полимеры, построенные из мономерных единиц. Исключением служат липиды, не являющиеся полимерами, так как молекулы в них не соединены между собой ковалентными связями. Углеводные полимеры построены на основе повторяющихся единиц одного, двух или более типов, например, запасной полисахарид гликоген , построенный из остатков глюкозы, или пептидогликан клеточной стенки, образованный чередованием N-ацетилглюкозамина и N- ацетилмурамовой кислоты. В клетке углеводные полимеры представлены часто одним видом молекулы ( табл. 9).
Полимерные молекулы белков и нуклеиновых кислот синтезируются на матрице, которая и определяет последовательность составляющих их мономеров. Возможности для синтеза разнообразных по функциям и структуре клеточных метаболитов реализуются на стадии сборки полимеров путем различных сочетаний исходных строительных блоков. В основе огромного числа видо-и функционально специфических белков лежат комбинации из 20 аминокислот , а чтобы зашифровать весь объем генетической информации одной клетки или многоклеточного организма оказалось достаточным комбинации из 4 нуклеотидов . Прокариотная клетка в норме содержит примерно 2000-2500 различных белков, каждый из которых представлен 400-1000 молекулами. Количество молекул нуклеиновых кислот каждого вида определяется их функциональным назначением: ДНК - одного вида и представлена одной или несколькими копиями; количество разных молекул РНК в клетке колеблется на несколько порядков
23) Типы энергетического и конструктивного метаболизма прокариот. Фототрофия и хемотрофия. Литотрофия и органотрофия. Автотрофия и гетеротрофия. Способы существования прокариот (8 типов). Облигатный и факультативный тип метаболизма.
В зависимости от того, какой источник энергии могут использовать прокариоты, их делят на фототрофов (источник энергии - свет) и хемотрофов (источник энергии - окислительно-восстановительные реакции).
Организмы, у которых источниками (донорами) электронов в энергетическом процессе являются неорганические вещества, предложено называть литотрофными , а те, у которых донорами электронов служат органические соединения, - органотрофными . Тогда в зависимости от источника энергии и природы донора электронов возможны четыре основных типа энергетического метаболизма: хемолитотрофия , хемоорганотрофия , фотолитотрофия и фотоорганотрофия .
У прокариот с хемотрофным типом энергетического метаболизма одно и то же соединение служит донором электронов, большая часть которых перемещается в соответствии с термодинамическим градиентом, что приводит к выделению свободной энергии, а меньшая - используется для образования восстановителя, потребляемого в конструктивном метаболизме. Это положение справедливо в отношении прокариот с энергетикой бродильного и дыхательного типов, при использовании в качестве энергетических ресурсов органических и неорганических соединений. У фототрофов использование света в качестве источника энергии требует дополнительного подключения химических соединений, служащих донорами электронов для образования восстановителя. Это связано со спецификой света как энергетического ресурса для живых систем.
Каждый тип энергетического метаболизма может осуществляться на базе различных биосинтетических способностей организма. Все прокариоты в зависимости от особенностей конструктивного метаболизма на две группы: автотрофов и гетеротрофов . Следовательно, можно выделить 8 сочетаний типов энергетического и конструктивного метаболизма, которые отражают возможности способов существования (питания) прокариот ( ).
Всем способам питания соответствуют реально существующие прокариотные организмы. Однако число видов прокариот, относящихся к группам, характеризующимся разными способами питания, далеко не одинаково. Подавляющее число прокариот сосредоточено в группе с хемоорганогетеротрофным типом питания.
Такая же неравномерность в распределении по типам питания присуща и фотосинтезирующим прокариотам. Большинство ( цианобактерии , пурпурные и зеленые серобактерии ) относится к группе с фотолитоавтотрофным способом питания.
Часто для характеристики способа питания прокариот пользуются более общими понятиями, чем приведенные, употребляя для этого сочетания только двух признаков: источник энергии (фото-, хемо-) + источник углерода для построения веществ тела (авто-, гетеро-).
Перечисленные сочетания основных видов энергетического метаболизма и конструктивного метаболизма характеризуют все возможные способы питания прокариотных организмов. Некоторые прокариоты могут существовать только на базе одного какого-нибудь способа питания. Например, одноклеточная цианобактерия Synechococcus elongatus может использовать в качестве источника энергии только свет, а как основной источник углерода в конструктивном метаболизме - углекислоту. Характеризуя способ существования (образ жизни, тип метаболизма) этого организма, мы говорим, что он облигатный фотолитоавтотроф, Многие бактерии, относящиеся к роду Thiobacillus , - облигатные хемолитоавтотрофы, т.е. источником энергии для них служат процессы окисления различных соединений серы, а источником углерода для построения веществ тела - углерод углекислоты.
Подавляющее большинство бактерий - облигатные хемоорганогетеротрофы, использующие в качестве источника углерода и энергии органические соединения.
Для некоторых представителей группы цианобактерий наряду с фотолитоавтотрофией показана способность к фотолито- или хемоорганогетеротрофии. Ряд хемолитоавтотрофных видов Thiobacillus способны существовать за счет использования в качестве источников энергии и углерода органических соединений, т.е.хемоорганогетеротрофно.
В приведенных выше примерах метаболические возможности указанных цианобактерий и видов Thiobacillus оказались гораздо шире, чем необходимо для осуществления метаболизма по одному типу. В этом случае мы говорим о том, что данные организмы - факультативные фотолитоавтотрофы или хемолитоавтотрофы, т.е. осуществление данного типа метаболизма не является для них единственным и обязательным ( облигатным ). Организмы, способные одновременно использовать два источника углерода (СО2 + органические вещества) и/или энергии (например, энергию света + энергию окисления химического соединения) называются миксотрофами .
В рамках разобранных выше основных способов питания, определяющих возможности существования прокариотных организмов, в мире прокариот обнаружено множество типов (форм) жизни. Тип жизни - понятие, отражающее, с одной стороны, специфику процессов энергетического метаболизма , с другой - специфику процессов конструктивного метаболизма , присущую определенной группе организмов. Разберем это на примере прокариот, для которых обязателен хемоорганогетеротрофный способ существования. Энергетические процессы этих организмов различаются исходными субстратами, специфичностью промежуточных окислительно-восстановительных превращений и природой конечных акцепторов электронов; конструктивные - разной степенью развития биосинтетических способностей, т.е. различными потребностями в готовых питательных веществах.
Наиболее примитивную и древнюю группу энергетических процессов составляют процессы брожения, когда органическое вещество служит донором и конечным акцептором электронов, а молекулярный кислород в реакциях окислительной природы участия не принимает. Известны молочнокислое, спиртовое, пропионовокислое, маслянокислое и некоторые другие виды брожения, каждое из которых является специфической формой решения "энергетической проблемы" и осуществляется группой прокариот, характеризующихся определенными биосинтетическими способностями. Известны прокариотные организмы, получающие энергию за счет процессов неглубокого или полного окисления органического субстрата молекулярным кислородом.
Таким образом, на базе хемоорганогетеротрофного способа питания можно выделить несколько типов жизни, представленных определенными группами прокариот, осуществляющими конкретный тип энергетического метаболизма в сочетании с присущими им особенностями метаболизма конструктивного .
24) Принцип приготовления питательных сред. Типы сред, используемые для культивирования микроорганизмов. Условия культивирования микроорганизмов.
В зависимости от видовой принадлежности микробов и целей культивирования консистенция и составы культуральных сред бывают разными и варьируют в широких пределах. Среда, отвечающая биологическим особенностям микроба и обеспечивающая его рост и размножение, называется полноценной, не имеющая какого- либо компонента, необходимого для его жизнедеятельности – дефицитной. Питательные среды классифицируют в зависимости от: v химического состава и исходных компонентов; Ø консистенции; · целевого назначения. В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред: - среды неопределенного химического состава (естественные или натуральные среды) – это среды, которые состоят из продуктов животного или растительного происхождения, имеющие сложный неопределенный химических состав: 1) среды животного происхождения (исходные продукты – мясо, рыба, яйца, молоко и т.д.) 2) среды растительного происхождения (исходные продукты – соя, горох, картофель, морковь и т.д.) На естественных средах хорошо развиваются микроорганизмы, однако эти среды малопригодны для контролируемого изучения физиологии обмена веществ микроорганизмов и диагностических исследований, поскольку они не позволяют учитывать потребности ряда компонентов среды, а с другой стороны определять вещества, образующие микроорганизмами. Естественные среды используют главным образом для поддержания культур микроорганизмов, накопления их биомассы и диагностических целей. «Полусинтетические» среды (гидролизатные), относящиеся к средам с неопределенным составом. В них, наряду с соединениями известной химической природы, входят вещества неопределенного состава. Их используют в микробиологической практике для получения витаминов, антибиотиков, аминокислот и других продуктов жизнедеятельности микроорганизмов (продукты гидролиза мяса, молока, дрожжей, крови и др. белковых веществ). Среды известного химического состава (синтетические) – в их состав включают известные химические соединения (соли, углеводы, аминокислоты, витамины и т.д.) в оптимальном количественном соотношении. Синтетические среды по составу бывают простыми или имеют относительно большой набор компонентов. Их используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред, например при получении диагностических аллергенов или при изучении метаболических потребностей микроорганизма в том или ином конкретном химическом соединение. Кроме того, исследователи стремятся определить для каждого микроорганизма минимальные потребности в питательных веществах и, исходя из этого, создать минимальную среду, содержащую лишь необходимы для его размножения химические соединения. По консистенции питательные среды дифференцируют на плотные, полужидкие и жидкие. Жидкие питательные среды. Готовят, используя экстракты, гидролизаты, растворы исходных продуктов. Полужидкие и плотные питательные среды. Используют для учёта количества бактерий, выделения их в виде «чистой» культуры и других целей. Необходимую консистенцию среде придают добавлением различных уплотнителей - агар-агар или желатину. Агар-агар (малайское желе)- растительный коллоид, получаемый из некоторых морских водорослей. В его состав входят главным образом полисахариды с ничтожным количеством азотистых веществ. Для получения плотных сред его добавляют в количестве 1,5-2%,полужидких –0,3-0,7%. Желатина – кислый азотистосодержащий продукт, добываемый при выварке костей и хрящей. Обычно в питательные среды вносят 10-20% желатины. Но ряд бактерий выделяют протеолитические ферменты, разлагающие желатину, что делает его неудобным для применения. По целевому назначению различают: А).Общеупотребительные (основные) среды. Их применяют для культивирования относительно неприхотливых микроорганизмов. Мясная вода: Получение – мясной фарш заливают водопроводной водой 1:2, кипятят 1ч., затем фильтруют, доливают водой до первоначального объема, разливают по емкостям, плотно закрывают и стерилизуют автоклавированием при 120ОС 20 мин. Перевар Хоттингера готовят из мясных отходов путем их триптического гидролиза. Жир, фасции, сухожилия нарезают, заливают кипящей водой 1:2, кипятят, охлаждают до 45ОС, добавляют панкреатин, подщелачивают раствором карбоната натрия, встряхивают, добавляют хлороформ, закрывают и выдерживают в теплом месте 10 дней. Мясо-пептонный бульон (МПБ). Для приготовления используют мясной бульон. К 1 л мясного бульона добавляют 5-10 г пептона (первый продукт гидролиза белка с высокой молекулярной массой) для повышения калорийности среды и 5 г NaCI для создания осмотической активности. Затем устанавливают нейтральную или слабощелочную реакцию среды. Кипятят. Фильтруют через бумажный фильтр, разливают по колбам, пробиркам и стерилизуют автоклавированием при 1200С 20 мин. Мясо–пептонный агар (МПА): к 1 л МПБ добавляют 15-20 г мелко нарезанного агар-агара. Среду нагревают до растворения агара, устанавливают слабощелочную реакцию среды 20%-ным раствором Na2CO3, фильтруют и через воронки разливают в пробирки, стерилизуют автоклавированием при1200 20 мин. Мясо-пептонная желатина (МПЖ). К 1 литру МПБ добавляют желатин до конечной концентрации 10-20%, нагревают, устанавливают слабо-щелочную pH, кипятят, фильтруют, разливают по пробиркам и стерилизуют в кипятильнике Коха текучим паром 3 дня или однократно автоклавированием при 1200С при 1 атм. течение 20 мин. Полужидкий мясо-пептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25% агара, кипятят до его расплавления, устанавливают требуемую pH, фильтруют в горячем виде и стерилизуют автоклавированием. Бульон Хоттингера: основной перевар Хоттингера разводят водой 1:5 (1:8), добавляют 0,5% NaСI, 0,1 г гидрофосфата калия, устанавливают pH, кипятят 150-20 мин, фильтруют, разливают по емкостям и стерилизуют автоклавированием при 1200 20 мин. Агар Хоттингера готовят, добавляя к бульону Хоттингера 2% агар-агара. Питательный бульон содержит: триптический гидролизат кильки –10,05, NaCI- 4,95. 15 г порошка этого бульона растворяют а 1 л дист. Воды, кипятят 2 мин, фильтруют, разливают по емкостям и стерилизуют а автоклаве при 1200С 20 мин (Ph 7,3). Питательный агар содержит: ферментативный гидролизат кормовых дрожжей – 12 г, агар- 12,5 г; NaCI –5,5 г. Навеску 36 г полученного порошка растворяют в 1 л дист. Н2О, кипятят 3 мин, фильтруют, стерилизуют автоклавированием при1200С 20 мин (pН 7,3). Б).Обогащенные среды. Многие виды болезнетворных бактерий плохо растут на обще-употребительных средах, поэтому в основные среды добавляют кровь, сыворотку крови, углеводы и т.д. Такие среды получили название обогащенных. Сывороточный и кровяной агары: к расплавленному и охлажденному стерильному питательному агару добавляют дефибринированной крови или сыворотки крови (лошади, КРС, кролика). Компоненты перемешивают, разливают в чашки Петри, пробирки и оставляют до застывания. Сывороточный и кровяной бульоны готовят аналогично. Растворы углеводов стерилизуют текучим паром или фильтрованием и добавляют в количестве 0,5- 1% к пит. среде. В).Специальные среды. Среды, разработанные с учетом специфических ростовых потребностей ряда бактерий. Среда Мак-Коя: куриные яйца обрабатывают спиртом, проводят через пламя горелки. Стерильно вскрывают, желтки отделяют от белков. К 60 частям желтков добавляют 40 ч физиологического раствора. Компоненты перемешивают и разливают в пробирки и помещают в наклонном положении в аппарат для свертывания сыворотки. Стерилизуют. Среда Терских состоит из фосфатной смеси Зеренсена и кроличьей сыворотки. Смесь Зеренсена: раствор А: гидрофосфат натрия, вода дист.; раствор Б: дигидрофосфат калия, вода дист. К 90 мл раствора А добавляют 10 мл раствора Б и доводят объем до 1000 мл, разливают по пробиркам, стерилизуют, а затем добавляют 6-8 капель стерильной инактивированной сыворотки кролика.
