
- •Бийский технологический институт (филиал)
- •Количественный учет микроорганизмов
- •Введение
- •1 Определение количества клеток микроорганизмов под микроскопом
- •1.1 Подсчет клеток на фиксированных окрашенных мазках (метод Виноградского – Брида)
- •1.1.1 Приготовление препарата
- •1.1.2 Правила подсчета
- •1.2 Подсчет клеток в счетных камерах
- •1.2.1 Заполнение камеры и подсчет клеток
- •1.3 Подсчет клеток на мембранных фильтрах
- •1.3.1 Приготовление фильтра
- •1.3.2 Правила подсчета
- •1.4 Метод микрокультур
- •2 Определение числа клеток микроорганизмов высевом на питательные среды
- •2.1 Определение количества клеток высевом на плотные питательные среды (метод Коха)
- •2.1.1 Приготовление разведений
- •2.1.2 Посев
- •2.1.3 Подсчет выросших колоний
- •2.2 Определение количества клеток высевом в жидкие среды (метод предельных разведений)
- •2.2.1 Приготовление разведений
- •2.2.2 Посев и регистрация результатов
- •2.2.3 Примеры расчета Пример 1
- •Пример 2
- •3 Определение биомассы взвешиванием
- •3.1 Доведение массы центрифужных пробирок или фильтров до постоянного значения
- •3.2 Отделение микроорганизмов от среды
- •3.3 Определение биомассы
- •4 Определение количества клеток и биомассы нефелометрическим методом
- •5 Практическая часть
- •5.1 Лабораторная работа № 1. Методы определения общего количества микроорганизмов в сыром молоке (6часов)
- •5.1.1 Определение общего количества бактерий в молоке методом посева
- •5.1.2 Подсчет микроорганизмов в мазках из молока методом Брида
- •5.1.3 Определение количества микроорганизмов в молоке
- •5.2 Лабораторная работа № 2. Методы количественного учета дрожжей (6 часов)
- •5.2.1 Метод Коха
- •5.2.2 Подсчет клеток в камере Горяева
- •5.2.3 Нефелометрический метод
- •5.2.4 Определение количества клеток дрожжей высевом в жидкие среды
- •5.3 Лабораторная работа № 3. Определение количества микроорганизмов в смыве с поверхности предметов. Санитарно-микробиологический контроль воздуха (6 часов)
- •5.3.1 Приготовление смывов
- •5.3.2 Микрофлора воздуха
- •6 Контрольные вопросы
- •7 Техника безопасности при выполнении лабораторных работ
- •Содержание
2 Определение числа клеток микроорганизмов высевом на питательные среды
2.1 Определение количества клеток высевом на плотные питательные среды (метод Коха)
Метод широко применяют для определения численности жизнеспособных клеток в различных естественных субстратах и в лабораторных культурах. В его основе лежит принцип Коха, согласно которому каждая колония является потомством одной клетки. Это позволяет на основании числа колоний, выросших после посева на плотную питательную среду определенного объема исследуемой суспензии, судить об исходном содержании в ней клеток микроорганизмов. Результаты количественного определения микроорганизмов, проведенного по методу Коха, часто выражают не в числе клеток, а в условных, так называемых колониеобразующих единицах (КОЕ). Каждая колония на чашке с питательной средой вырастает из одной колониеобразующей единицы, которая может представлять собой бактериальную, дрожжевую клетку, спору, кусочек мицелия актиномицета или гриба.
Определение числа микроорганизмов этим методом включает три этапа: приготовление разведений, посев на плотную среду в чашки Петри и подсчет выросших колоний.
2.1.1 Приготовление разведений
Численность популяции микроорганизмов обычно велика, поэтому для получения изолированных колоний необходимо приготовить ряд последовательных разведений. Разведения готовят в стерильной водопроводной воде или в 0,85%-ном растворе NaCL (физиологическом растворе). В ходе опыта целесообразно использовать один и тот же коэффициент разведения, например 10, что уменьшает вероятность ошибки.
Для приготовления разведений стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1 мл исследуемой суспензии стерильной пипеткой переносят в пробирку с 9 мл стерильной воды – это первое разведение (101). Полученное разведение тщательно перемешивают новой стерильной пипеткой, несколько раз вбирая в пипетку и выпуская из нее полученную суспензию клеток. Затем той же пипеткой отбирают 1 мл суспензии и переносят во вторую пробирку, получая второе разведение (102). Таким же образом готовят последующие разведения. Степень разведения зависит от плотности исследуемой популяции микроорганизмов; соответственно она тем больше, чем больше плотность популяции.
Для приготовления каждого разведения следует обязательно использовать новую пипетку. Пренебрежение этим правилом приводит к получению ошибочного результата вследствие высокой способности клеток микроорганизмов к сорбции на поверхности стекла.
2.1.2 Посев
Высевать суспензию можно поверхностным или глубинным способом. Перед посевом поверхностным способом (рисунок 2) разливают расплавленную агаризованную питательную среду в ряд стерильных чашек Петри от 15 до 20 мл в каждую. Чашки оставляют на горизонтальной поверхности, пока среда не застынет. Поверхности агаризованных сред перед посевом рекомендуется подсушить для удаления конденсационной воды, например, поместив чашки в термостат на 2…3 суток крышками вниз.
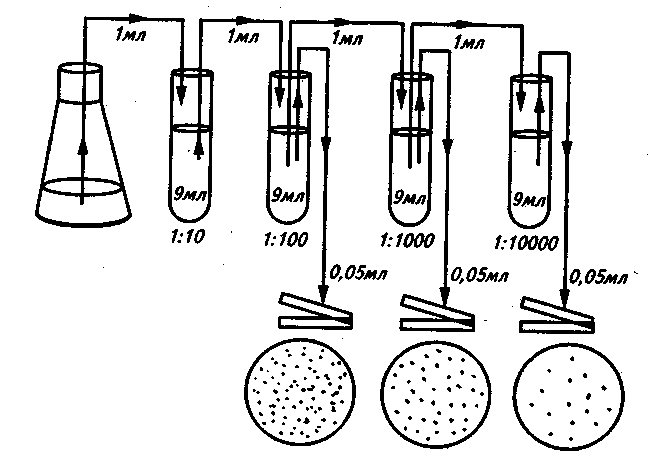
Рисунок 2 – Схема приготовления разведений и посева суспензии микроорганизмов
В чашку Петри с подсушенной средой вносят точно измеренный объем (0,05 или 0,1 мл) соответствующего разведения и распределяют его стеклянным шпателем по поверхности среды. Высевы на плотную среду проводят, как правило, из трех последних разведений, причем из каждого делают от двух до четырех параллельных высевов. Посевы можно делать одной пипеткой, но при этом начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель. После посева чашки Петри помещают в термостат крышками вниз.
При глубинном посеве точно измеренный объем (как правило, 0,1; 0,5 или 1,0 мл) исходной суспензии или разведения вносят в расплавленную и остуженную до 45…50 ºС среду, тщательно перемешивают, затем немедленно выливают в чашку Петри и дают среде застыть. В случае глубинного посева пользуются средой, разлитой в пробирки. При больших масштабах работы среду по пробиркам не разливают, а поступают следующим образом. По 1 мл из соответствующего разведения переносят стерильной пипеткой в 2…4 стерильные чашки Петри. Затем заливают в чашки по 15…20 мл среды, расплавленной и остуженной до 45…50 ºС, и смешивают питательную среду с посевным материалом легким вращательным движением чашки по поверхности стола, после чего чашки оставляют на горизонтальной поверхности до застывания среды. Когда среда застынет, чашки Петри в перевернутом виде помещают в термостат.
Для определения количества клеток анаэробных микроорганизмов чашки Петри после посева помещают в анаэростат. Иногда для определения численности анаэробов плотную среду после засева оставляют в пробирках. Поверхность застывшей среды заливают парафином. Для лучшего учета колоний микроорганизмов среды в этом случае рекомендуется осветлять.
