
- •Термодинамика.
- •Нормальные условия
- •Газовые смеси.
- •Калорические параметры состояния.
- •Энтропия.
- •Теплоемкость вещества.
- •Законы термодинамики.
- •Параметры тела при заданных параметрах и при заданных параметрах окружающей среды.
- •Основные термодинамические процессы.
- •Влажный воздух.
- •Лекция №8
- •Цикл энергетических установок.
- •Паротурбинная установка пту.
- •Газотурбинная установка (гту) – рабочим телом является газ.
- •Парогазовые установки (пгу).
- •Циклы двигателей внутреннего сгорания (Отто, Дизеля, Тримплера).
- •Основы теории теплообмена.
- •Количественные характеристики переноса теплоты:
- •Основной закон теплопроводности. Закон Фурье.
- •Примечание к уравнению теплопередачи.
Параметры тела при заданных параметрах и при заданных параметрах окружающей среды.
![]()
а) Р = const

П = Тос∆S – потеря энергии
Всякое увеличение энтропии системы есть качественная мера потери ее работоспособности, вследствие протекания в системе необратимых процессов, протекающих в системе.
Основные термодинамические процессы.
Изобарный процесс Р = const;
Изохорный процесс V = const;
Изотермический процесс T = const;
δq = 0 (q = 0) адиабатный процесс;
Политропный процесс – CП = const
Этапы исследования термодинамических процессов.
1)Вывод уравнения процесса и установление взаимосвязи между параметрами состояния;
2)расчет работы и теплоты процесса;
3)определение изменения калориметрических параметров (∆U, ∆h, ∆S)
При исследовании за основу берется уравнение PV = const.
PV = RT
Уравнение I закона термодинамики:

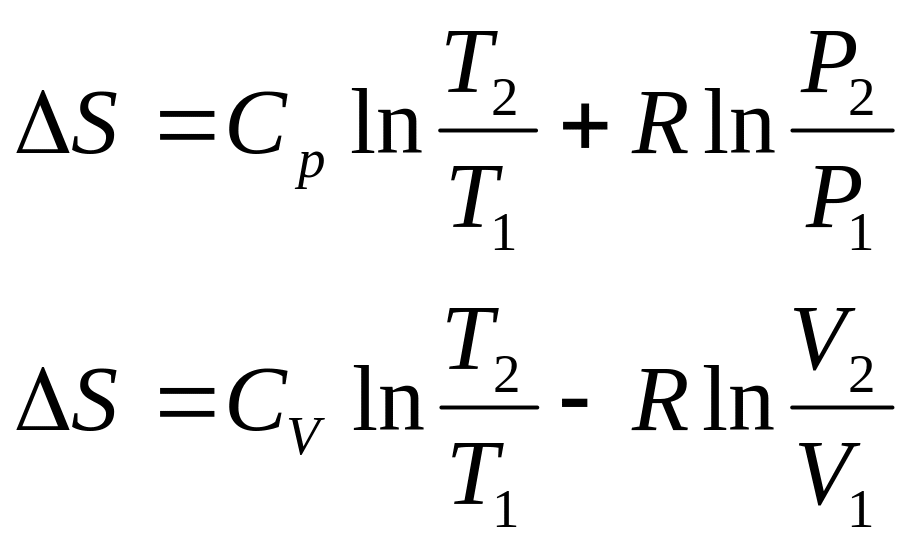
Политропный процесс.
СП = const
PVn = const – уравнение политропы,
n - показатель политропы, - ∞ ≤ n ≤ + ∞
n = 0 → P = const,
n = 1 → T = const,
n = k → адиабатный
n = ∞ → ν = const
1 < n < k для (реальных) идеального газа

Определение работы в политропном процессе.
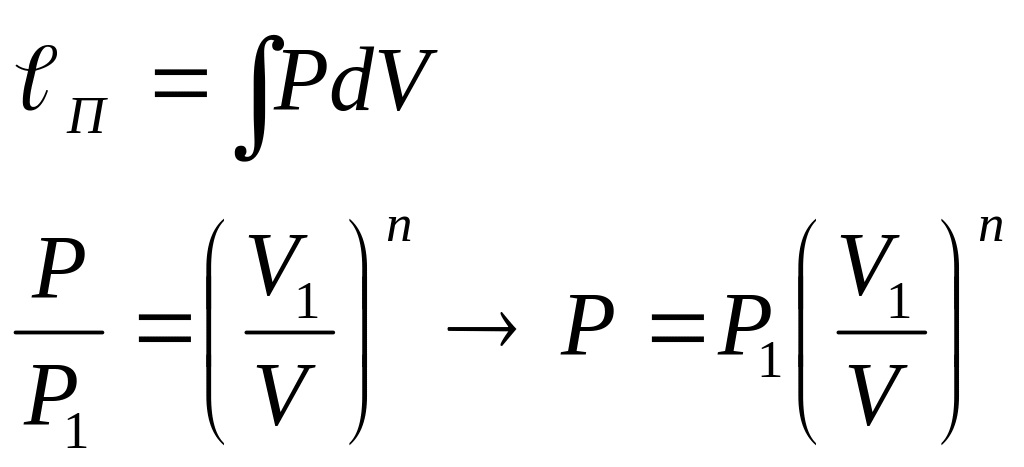
P, V – текущие значения
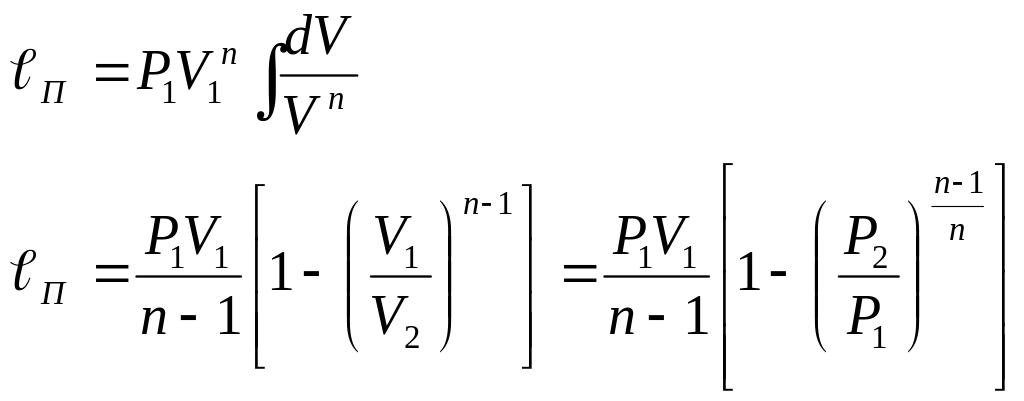
для идеального газа:
![]()
Теплота политропного процесса:
![]()
![]() уравнение
Майера
уравнение
Майера

Изменение ∆U, ∆h, ∆S:

Изображение процесса в P – V и T – S координатах:
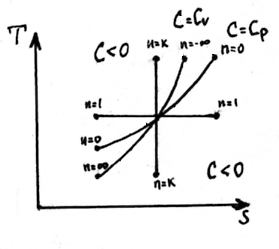
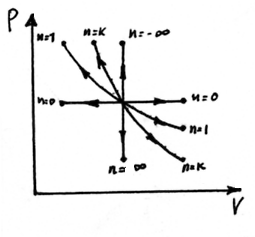
адиабатный и изоэнтропийный процесс.
Водяной пар. Термодинамические свойства воды и водяного пара.
Существует 7 видов льда:
0,001˚ С, Р = 611 кПа;
- 22˚ С, Р = 207,5 МПа;
- 34,7˚ С, Р = 213 МПа;
- 24,3˚ С, Р = 344 МПа;
- 17˚ С, Р = 346 МПа;
0,16˚ С, Р = 637 МПа;
81,6˚ С, Р = 2200 МПа.
Критическая температура – это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара.
Тройная точка – это то единственное состояние, в котором могут одновременно находиться в равновесии лед, вода и пар.
Пар можно получить при кипении и испарении.
Пар при испарении теоретически образуется при любой Т, а при кипении - при Т насыщения.
Процесс конденсации обратный парообразованию.
Пар.
1) Насыщенный – при параметрах насыщения Рн и tн
2) перегретый – имеет Т больше, чем температура насыщения пара такого же давления.
- влажный насыщенный – содержит капли влаги;
- сухой насыщенный – не содержит влаги;
Вводится дополнительный параметр:
х – степень сухости, 0 ≤ х ≤ 1
![]()
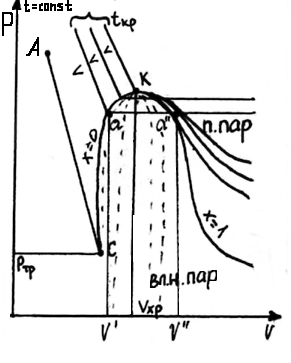
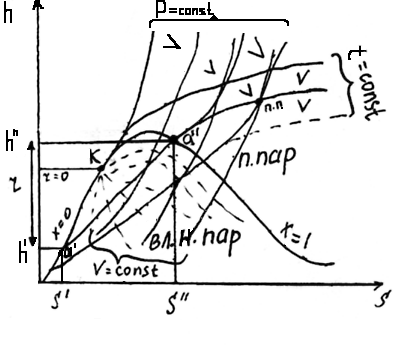
х = 0 – кипящая жидкость (V’, h’, S’);
х = 1 – сухой насыщенный пар (V’’, h’’, S’’)
0 ≤ х ≤ 1 – влажный насыщенный пар (Vx, hx, Sx)
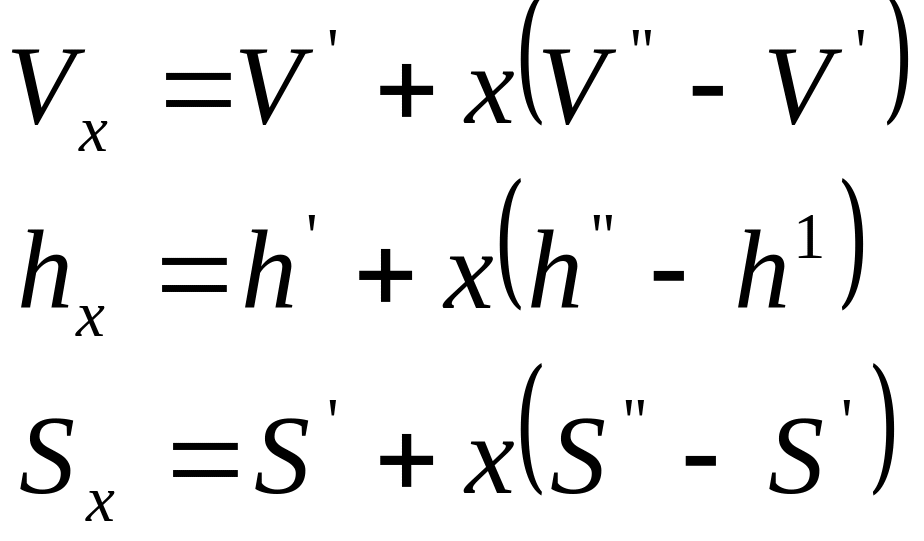
 (Pн, tн)
(Pн, tн)
V, h, S – параметры воды и перегретого пара.
(Р, t)
Тройная точка: tтр = 0,01˚ С
Ртр = 611 Па, V = 0,001
Критическая точка: tкр = 374,12˚ С
Ркр = 221,15 бар
= 22,115 МПа, V = 0,003147
![]()
P, V; T, S; h, S
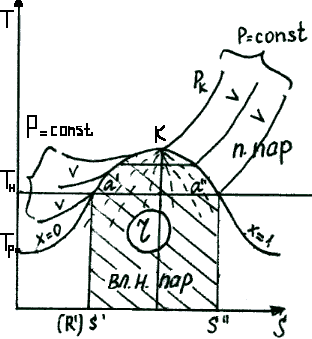
C – тройная точка; t > tн Изобарно-изотермический процесс
К – критическая точка;
![]() удельная теплота парообразования
удельная теплота парообразования
АС – таяние льда.
![]()
Удельная теплота парообразования – это теплота, которую необходимо подвести к 1 кг кипящей жидкости с тем, чтобы ее полностью превратить в сухой насыщенный пар.
B, T, S – r площадь, а b, h, s – r длина отрезка.
Первая часть таблицы связана с рассмотрением водяного пара в состоянии насыщения.
![]()
1 бар 99,63
100 1,003
Вторая часть таблица для воды и перегретого пара.
|
P |
P |
|||
t |
tн
|
|
|||
|
V |
h |
S |
V |
h |
V, h, S → (P, t)
(Истечение газов и паров)

