
- •Термодинамика.
- •Нормальные условия
- •Газовые смеси.
- •Калорические параметры состояния.
- •Энтропия.
- •Теплоемкость вещества.
- •Законы термодинамики.
- •Параметры тела при заданных параметрах и при заданных параметрах окружающей среды.
- •Основные термодинамические процессы.
- •Влажный воздух.
- •Лекция №8
- •Цикл энергетических установок.
- •Паротурбинная установка пту.
- •Газотурбинная установка (гту) – рабочим телом является газ.
- •Парогазовые установки (пгу).
- •Циклы двигателей внутреннего сгорания (Отто, Дизеля, Тримплера).
- •Основы теории теплообмена.
- •Количественные характеристики переноса теплоты:
- •Основной закон теплопроводности. Закон Фурье.
- •Примечание к уравнению теплопередачи.
![]() Литература:
Литература:
1) Теплотехника под редакцией Баскакова – 1982, 1991
2) Техническая термодинамика и теплопередача – Нащекин
Термодинамика.
Изучает закономерности превращения одних видов энергии в другие. Энергия – это количественная мера движения материи.
1) Различают: внутреннюю энергию и энергию в переходе термодинамической системы из одного состояния в другое. Термодинамическая система – это совокупность материальных тел, находящихся в механической и тепловой взаимосвязи между собой. Тела не входящие в нее образуют окружающую среду. Между системой и окружающей средой существует контрольная поверхность, оболочка. Хаотическое движение, внутримолекулярное движение связаны с внутренней энергией.
Энергию в переходе можно рассматривать как формы переноса энергии: теплота и работа. Способы переноса теплоты: кондукция, конвекция и излучение. Виды работы: механическая, электрическая, магнитная.
О различиях в теплоте и работе судим по принципу превратимости: работа может быть полностью превращена в тепло, но, теплота не может полностью превратиться в работу. Перенос энергии в форме теплоты связан с хаотическим движением частиц, работа же связана с упорядоченным движением.
- Работа L, Дж
- Удельная работа l,
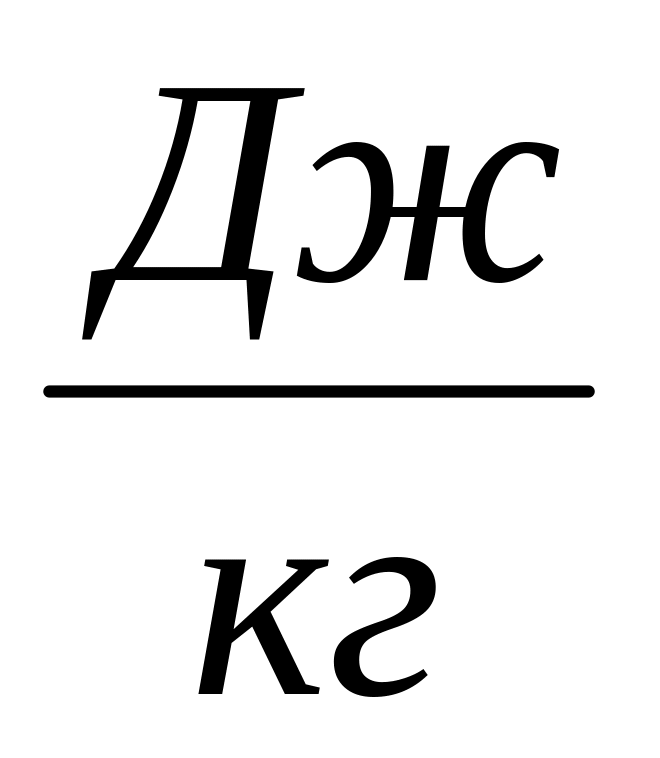
- Теплота Q, Дж
1Дж (L) = 1Дж (Q) они разные по качеству
- Удельная теплота q,
|
Подвод |
Отвод |
L |
− |
+ |
Q |
+ |
− |
Открытой называется термодинамическая система, которая может обмениваться с окружающей средой веществом. Если вещество не проходит через границы системы, то она называется закрытой.
2) Основные термические параметры состояний.
- абсолютное давление,

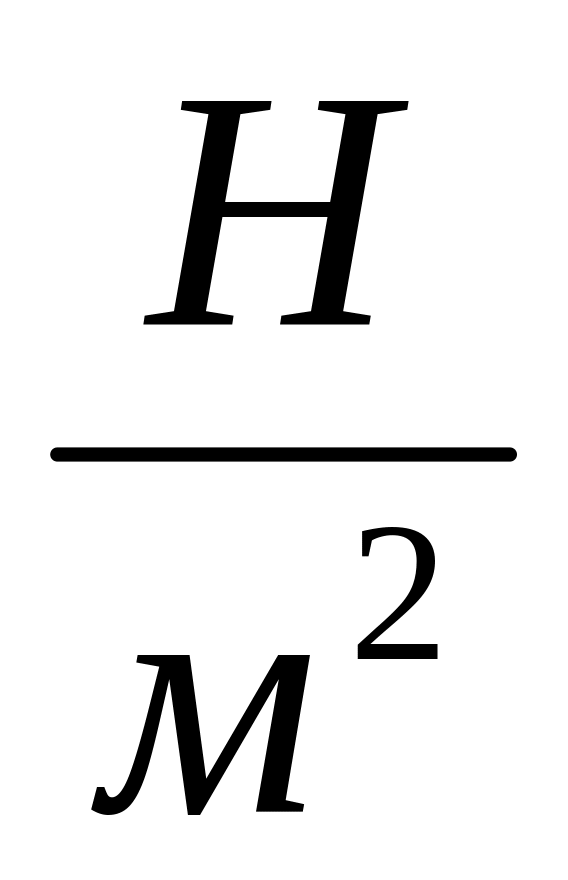
 ;
;- абсолютная температура;
- удельный объем.
103 Па = 1кПа
106 Па = 1МПа
105 Па = 1 бар
ат
![]()
мм. рт. ст.
м. вод. ст.
Теплоизолированной (адиабатной) называется термодинамическая система, которая не может обмениваться теплотой с окружающей средой.
Система, не обменивающаяся с окружающей средой ни энергией, ни веществом называется изолированной.
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью.
Температурой называется физическая величина, характеризующая степень нагретости тела.
![]() ,
то
,
то
![]() (манн)
(манн)![]()
![]() ,
то
,
то
![]() (разр)
(разр)
Абсолютная температура
Т, К
0 К – всякое движение отсутствует
273,16 К – соответствует состоянию характерного для тройной точки, лед + вода + пар, находящейся в термодинамическом равновесии.
1 К =
![]()
t, C˚
0˚ C – таянье льда
100˚ С – кипение воды при нормальном
![]()
1˚ С =
![]() ,
tтр = 0,01˚ С, Ртр
= 611 Па
,
tтр = 0,01˚ С, Ртр
= 611 Па
Т – 273,16 = t – 0,01
Т = 273,15 + t ∆T = ∆t
Фаренгейт
t =
![]()
Ренкин 1R =
![]()
Удельный объем:
![]()
![]() удельный объем – это объем единицы
массы вещества.
удельный объем – это объем единицы
массы вещества.
Нормальные условия

Р = 760 мм. рт. ст. = 101,325 кПа
Нормальные физические условия
t = 0˚ С = 273 К
Р = 735,6 мм.рт.ст = 98,1 кПа
Нормальные технические условия
t = 15˚ С = 288 К
Идеальным называется газ, в котором отсутствуют силы взаимодействия между молекулами, размер самих частиц бесконечно мал по сравнению с расстоянием между ними.
К идеальным газам относят: атмосферный воздух (водяной пар), продукты сгорания органического топлива. Водяной пар полученный из Н2О в результате подвода к ней Q – есть реальный газ.
Уравнение Клапейрона.

![]()
![]() - газовая постоянная – это есть работа,
которую надо совершить над 1 кг газа в
изобарном процессе с тем, чтобы его
температура изменилась на 1К.
- газовая постоянная – это есть работа,
которую надо совершить над 1 кг газа в
изобарном процессе с тем, чтобы его
температура изменилась на 1К.
Уравнение Менделеева – Клапейрона.

![]()
![]()
![]()
![]() универсальная газовая постоянная.
универсальная газовая постоянная.
Для реального газа данное уравнение справедливо, для них используется уравнение Ван-дер-Ваальса:
![]()

a и b – на практике используют таблицы и диаграммы.
