
- •Расшифровка электронной конфигурации
- •Формулировка правила Клечковского
- •Сродство к электрону
- •1 Метод вс
- •2 Метод мо
- •По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам.
- •Перекрывание атомных s- орбиталей происходит вблизи прямой, соединяющей ядра атомов н, т.Е. Оси. Такая связь называется сигма связью – σ связь.
- •В образовании σ связи могут принимать участие и р-электроны. Sp3-гибридизация
- •Факторы, влияющие на прочность водородной связи
- •Влияние водородной связи на физические свойства молекул
- •Применение в химии
- •Константа равновесия, величина, определяющая для данной хим. Р-ции соотношение между термодинамич. Активностями исходных в-в и продуктов в состоянии хим. Равновесия.
- •Произведение растворимости (пр) – это произведение равновесных концентраций ионов малорастворимого электролита.
- •Реакции ионного обмена
- •Электролитическая диссоциация воды
- •Вывод значения pH
- •Гидролиз солей – это реакция обменного взаимодействия соли с н2о, в результате чего образуется слабый электролит.
Перекрывание атомных s- орбиталей происходит вблизи прямой, соединяющей ядра атомов н, т.Е. Оси. Такая связь называется сигма связью – σ связь.
Но при взаимодействии р-электронов перпендикулярно оси связи, образуется не одна, а две области перекрывания, такая связь называется Пи – связью. (π – связь).
Гибридизация орбиталей — процесс смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами.
|
В образовании σ связи могут принимать участие и р-электроны. Sp3-гибридизация
происходит при смешивании одной s- и трех p-орбиталей. Возникают четыре одинаковые орбитали, расположенные относительно друг друга под тетраэдрическими углами 109°28’ (109.47°)
sp2-гибридизация
происходит при смешивании одной s- и двух p-орбиталей . Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей.
sp-гибридизация
происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
№19.
Полярная и неполярная ковалентная связь.
Если двухатомная молекула состоит из атомов одного элемента, то электронное облако распределяется в пространстве симметрично относительно ядер атомов. Такая ковалентная связь называется неполярной. Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной. В результате образования полярной ковалентной связи более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд. Эти заряды принято называть эффективными зарядами атомов в молекуле. Они могут иметь дробную величину
Систему из двух разноименных электрических зарядов, равных по абсолютной величине, называют диполем
№20.
Метод молекулярных орбиталей — метод построения электронных структур молекул. Основан на нескольких принципах:
1. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов
2. Состояние электрона в атоме описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). В отличие от атомных орбиталей, МО многоцентровая.
3. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации.
4. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы.
5. Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, принципу заполнения электронных структур Aufbau.
В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей (приближение МО ЛКАО).
Сколько атомных орбиталей содержат атомы, столько будет и молекулярных орбиталей.
Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих молеклярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участие в образовании химической связи не принимают.
МО, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой сигма , а из ру- и рz- – буквой пи .
![]()
![]()
![]()
№21.
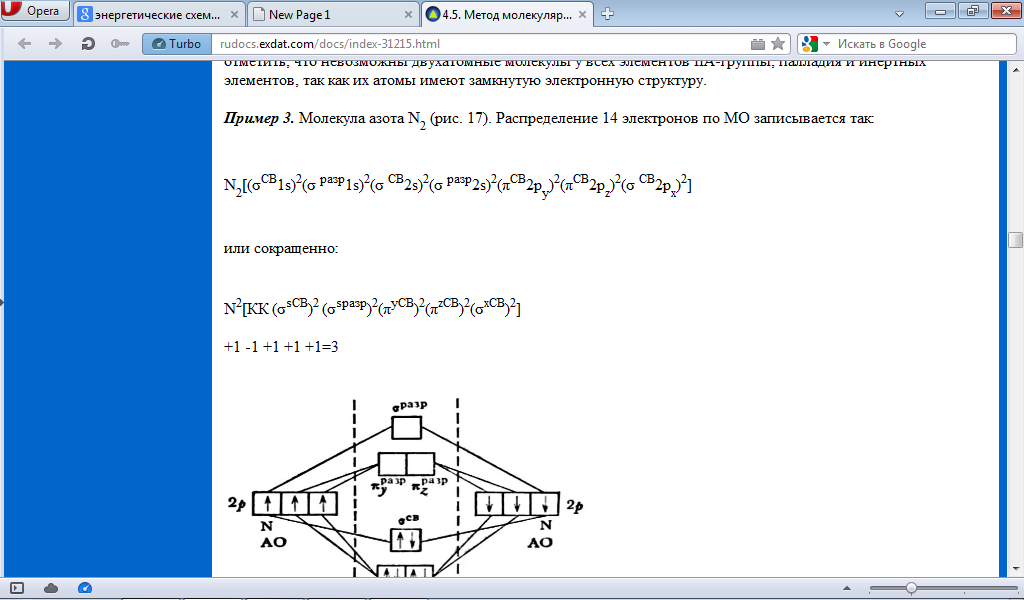 Под
формулой указано число связей в молекуле,
исходя из расчета, что два электрона,
расположенные на одной МО, образуют
валентную связь; знак плюс обозначает
связующие орбитали, знак минус –
разрыхляющие. Число связей в молекуле
3. нет неспаренных электронов – молекула
диамагнитна.
Под
формулой указано число связей в молекуле,
исходя из расчета, что два электрона,
расположенные на одной МО, образуют
валентную связь; знак плюс обозначает
связующие орбитали, знак минус –
разрыхляющие. Число связей в молекуле
3. нет неспаренных электронов – молекула
диамагнитна.
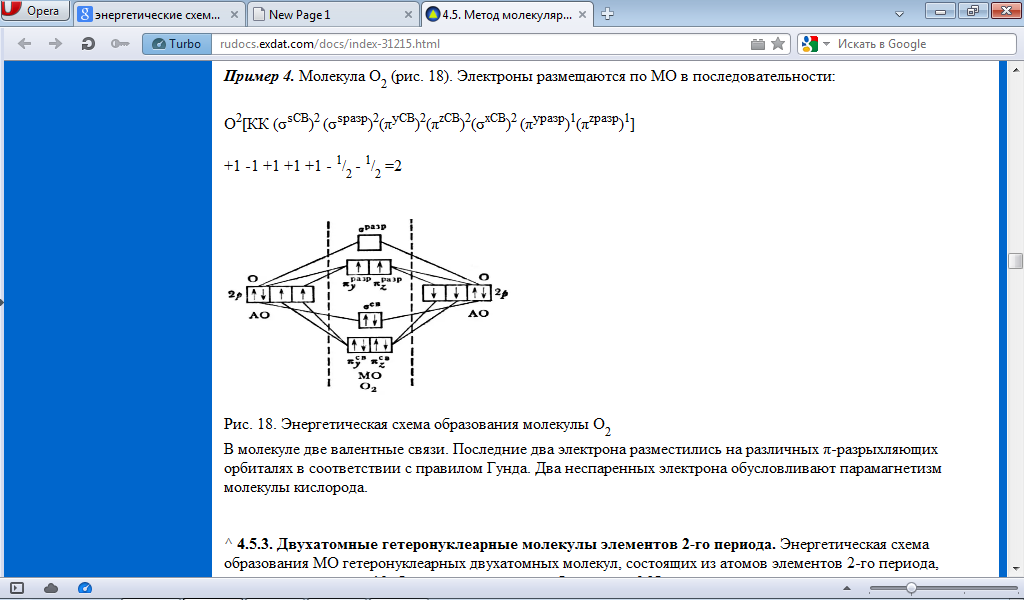 В
молекуле две валентные связи. Последние
два электрона разместились на различных
π-разрыхляющих орбиталях в соответствии
с правилом Гунда. Два неспаренных
электрона обусловливают парамагнетизм
молекулы кислорода.
В
молекуле две валентные связи. Последние
два электрона разместились на различных
π-разрыхляющих орбиталях в соответствии
с правилом Гунда. Два неспаренных
электрона обусловливают парамагнетизм
молекулы кислорода.
К-внутренний уровень
№22.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Если химическая связь образуется между атомами, которые имеют очень большую разность ЭО (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов: А• + •В = А+ + [:В]-
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью.
Валентность — способность атомов химических элементов образовывать химические связи с атомами других элементов. В свете строения атома валентность - это способность атомов отдавать или присоединять определенное число электронов. В соединениях, образованных при помощи ионных связей, валентность атомов определяется числом присоединенных или отданных электронов. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся «общих» электронных пар.
Металлическая связь — химическая связь, обусловленная свободными электронами. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
№23.
Водородная связь — разновидность невалентного взаимодействия между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H•••BR различной степени стабильности, в которых атом водорода выступает в роли мостика, связывающего фрагменты RA и BR.
