
- •Расшифровка электронной конфигурации
- •Формулировка правила Клечковского
- •Сродство к электрону
- •1 Метод вс
- •2 Метод мо
- •По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам.
- •Перекрывание атомных s- орбиталей происходит вблизи прямой, соединяющей ядра атомов н, т.Е. Оси. Такая связь называется сигма связью – σ связь.
- •В образовании σ связи могут принимать участие и р-электроны. Sp3-гибридизация
- •Факторы, влияющие на прочность водородной связи
- •Влияние водородной связи на физические свойства молекул
- •Применение в химии
- •Константа равновесия, величина, определяющая для данной хим. Р-ции соотношение между термодинамич. Активностями исходных в-в и продуктов в состоянии хим. Равновесия.
- •Произведение растворимости (пр) – это произведение равновесных концентраций ионов малорастворимого электролита.
- •Реакции ионного обмена
- •Электролитическая диссоциация воды
- •Вывод значения pH
- •Гидролиз солей – это реакция обменного взаимодействия соли с н2о, в результате чего образуется слабый электролит.
1 Метод вс
1. Химическая связь образуется парой электронов с противополжным спинами, которые локализованы между двумя атомами. При этом обобщенные электроны принадлежат в равной степени обоим атомам.
2. Число связей, образованным данным атомом равно числу неспаренных частиц (электронов) в основном и неспаренном состоянии (валентность).
3. Электронные пары, не участвующие в образовании связей, называются неподелёнными электронными парами.
2 Метод мо
Обобщением представлений о химической связи является метод молекулярных орбиталей. Молекулярные орбитали конкретной молекулы можно получить в виде сумм и разностей АО входящих в нее атомов. Помимо развития наглядных представлений о распределении электронов в молекуле, метод может использоваться для приближенного решения уравнения Шредингера. Согласно метода молекулярных орбиталей молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и ядер. Молекула рассматривается как единое целое и имеет ≪орбитальное≫ строение, при этом все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Указанный метод называют МО ЛКАО – Молекулярная орбиталь есть линейная комбинация атомных орбиталей.

№16.
Ковалентная связь — связь, образованная направленными валентными электронными облаками. Нейтральные атомы размещены в узлах кристаллической решётки.
Определение Ковалентной связью называется химическая связь, образующаяся за счет обобществления атомами своих валентных электронов. Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны. В простейшем случае перекрывание двух АО приводит к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
Образование связи Ковалентная связь — связь между двумя атомами за счет обобществления двух электронов — по одному от каждого атома: A. + В. -> А : В
По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам.
Кратные связи Согласно принципу локализованных электронных пар метода валентных связей одинарной связью называется химическая связь, осуществляемая одной электронной парой. Одинарные связи практически всегда представляют собой s-связи. s-связью называется химическая связь, по которой через линию связи не проходит ни одной узловой плоскости. Между двумя атомами может образовываться только одна s-связь. То, что между двумя атомами может образовываться только одна s-связь, отнюдь не означает, что между ними не может быть образована дополнительная связь. Химическая связь, осуществляемая более чем одной электронной парой, называется кратной связью. Кратность связи — это число общих электронных пар, участвующих в образовании связи. Кратная связь может быть двойной, тройной, иметь более высокую кратность и даже дробную кратность. Кратная связь состоит из одной s-связи, p-связи и иногда d-связи |
№17.
Механизмы образования ковалентной связи
Cвязь между атомами возникает при перекрывании их атомных орбиталей с образованием молекулярных орбиталей (МО). Различают два механизма образования ковалентной связи:
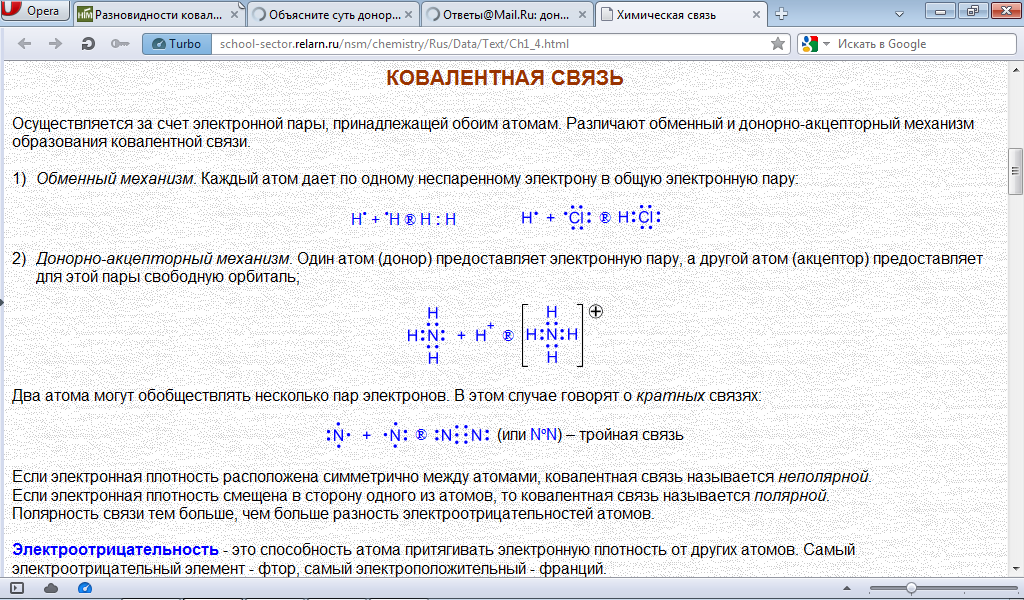
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора
Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь
18. Характерные свойства ковалентной связи - направленность, насыщаемость - определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными. Направленность ковалентной связи связана с направленностью электронных облаков. Электронные облака имеют различную форму, и их взаимное перекрывание может осуществляться различными способами.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Насыщаемость – одно и важнейших свойств ковалентной химической связи. Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой. Каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар, таким образом, связь локализована между двумя атомами, то есть она двухцентровая и двухэлектронная. Количество связей ограничено числом валентных электронов и числом валентных орбиталей, поэтому связь насыщенна.
