
- •Расшифровка электронной конфигурации
- •Формулировка правила Клечковского
- •Сродство к электрону
- •1 Метод вс
- •2 Метод мо
- •По этой причине гомеополярная связь имеет направленный характер. Пара электронов, осуществляющая связь, принадлежит одновременно обоим связываемым атомам.
- •Перекрывание атомных s- орбиталей происходит вблизи прямой, соединяющей ядра атомов н, т.Е. Оси. Такая связь называется сигма связью – σ связь.
- •В образовании σ связи могут принимать участие и р-электроны. Sp3-гибридизация
- •Факторы, влияющие на прочность водородной связи
- •Влияние водородной связи на физические свойства молекул
- •Применение в химии
- •Константа равновесия, величина, определяющая для данной хим. Р-ции соотношение между термодинамич. Активностями исходных в-в и продуктов в состоянии хим. Равновесия.
- •Произведение растворимости (пр) – это произведение равновесных концентраций ионов малорастворимого электролита.
- •Реакции ионного обмена
- •Электролитическая диссоциация воды
- •Вывод значения pH
- •Гидролиз солей – это реакция обменного взаимодействия соли с н2о, в результате чего образуется слабый электролит.
№1.
Материя - в химии представляется в виде атомов, атомных ядер и электронов, обладающих свойством образования между собой химических связей при соединении в молекулы.
Вещество – это вид материи, имеющий массу покоя. Весь окружающий нас материальный мир состоит, во-первых, из веществ и, во-вторых, из различных полей (например, существуют поля тяготения, электромагнитные поля и др.). Вещества могут быть газообразными, жидкими или твердыми, чистыми и содержащими примеси, растворимыми в воде и практически нерастворимыми, ядовитыми и неядовитыми, устойчивыми при хранении и быстро разлагающимися уже при комнатной температуре.
А́том — наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Атомы различного вида в различных количествах связанные межатомными связями образуют молекулы
Моле́кула — частица, образованная двумя или большим количеством атомов, характеризующаяся определённым количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом ядра.
Валентность— способность атомов химических элементов образовывать химические связи с атомами других элементов. В свете строения атома валентность - это способность атомов отдавать или присоединять определенное число электронов. В соединениях, образованных при помощи ионных связей, валентность атомов определяется числом присоединенных или отданных электронов.
Сте́пень окисле́ния — вспомогательная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электростатического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Молекуля́рная ма́сса — масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе. Однако следует чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и различаются по размерности.
А́томная ма́сса, относительная атомная масса — значение массы атома, выраженное в атомных единицах массы.
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Единица измерения количества вещества в СИ — моль.
Моль — единица измерения количества вещества в СИ. Соответствует количеству вещества, содержащему столько специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц), сколько содержится атомов в 12 грамм нуклида углерода 12C.
Количество частиц в одном моле любого вещества постоянно и носит название числа Авогадро (NA).
№2.
Закон сохранения массы — исторический закон физики, согласно которому масса как мера количества вещества сохраняется при всех природных процессах, то есть несотворима и неуничтожима. С точки зрения современной физики, этот закон неверен. Например, при радиоактивном распаде совокупная масса вещества уменьшается.
Закон сохранения энергии — основной закон природы, заключающийся в том, что энергия замкнутой системы сохраняется во времени. Другими словами, энергия не может возникнуть из ничего и не может в никуда исчезнуть, она может только переходить из одной формы в другую.
Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). «…свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Закон Авогадро (1811г.) Равные объемы газов при одинаковых температурах и давлении содержат одинаковое число молекул в одном моле вещества: 6,21023
Следствие: моль любого газа при одинаковых условиях занимает один и тот же объем 22,4 л.
Уравнение Клапейрона-Менделева:
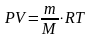
Нормальные условия: давление (Р) = 101,3кПа
объем (V) = 22,4 л
температура (Т) = 273К
Универсальная газовая постоянная R = 8,31 Дж/моль К - работа расширения идеального газа при нагревании его на один градус.
3.Стехиометрические законы химии:
Закон постоянства составов (Пруст 1808г.) Всякое чистое вещество независимо от способа его получения имеет постоянный состав.
Закон эквивалентов (Рихтен Вернер 1791г.) Эквиваленты всегда соединяются друг с другом в массовых количиствах - пропорциональной их эквивалентам или эквивалентной массой. (чем больше валентность, тем меньше эквивалентность эквивалентность элемента):
эквивалентность элемента = атомная масса / валентность
эквивалентность оксида = Ээлемента + Эо
экви. основания = молярная масса / число группы ОН
эквивалентность кислот = молярная масса / число водорода
эквив.соли=молярная масса/число атомов металвалентность
Эквивалент вещества - это количество вещества, эквивалентное 1 молю атомов водорода в различных химических реакциях, 1 молю ионов водорода (H+) в кислотно-основных или ионообменных реакциях, а также 1 молю электронов в окислительно-восстановительных реакциях.
Таким образом, эквивалент элемента определяется как количество элемента, приходящееся на единицу валентности, проявляемой им в реакции:
Ээл = Мэл / вал. (эквивалент вещества - это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений.)
Эквивалентная масса (молярная масса эквивалента вещества) Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению
mэкв(оксида) = Моксида/(число атомов кислорода · 2);
mэкв(основания) = Моснования/кислотность основания;
mэкв(кислоты) = Мкислоты/основность кислоты;
mэкв(соли) = Мсоли/(число атомов металла · валентность металла).
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например: mэкв(Fe2O3) = М(Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв(H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв(Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв(Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
Эквивалентный объем кислорода равен отношению молярного объема к эквивалентному количеству вещества.
4.Классификация
неорганических веществ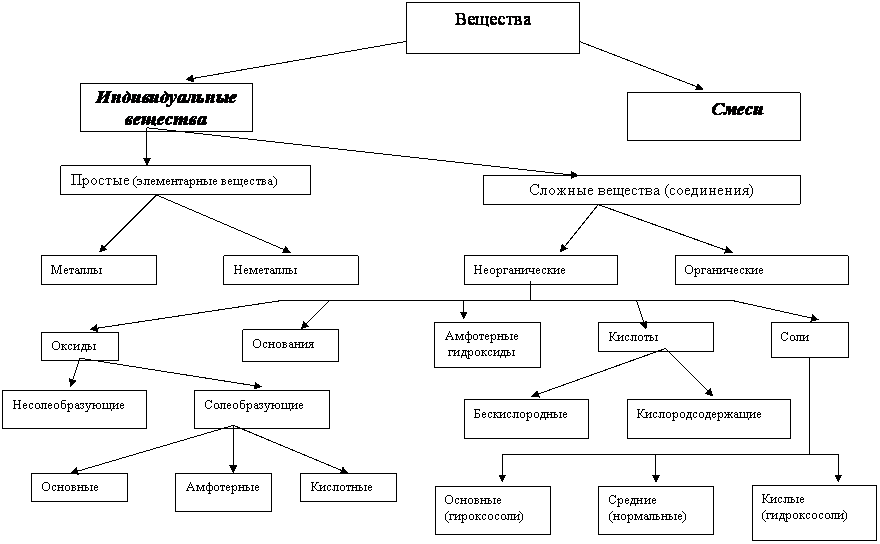
Металлы – группа элементов, обладающая характернымиметаллическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы OH-.
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных илиосно́вных гидроксидов.
Номенклатура
Номенклатура ИЮПАК (IUPAC) разработана Международным союзом теоретической и прикладной химии. По ее условиям каждое химическое вещество должно получать систематическое название в соответствии с его формулой и строением, но для некоторых веществ допускается использование традиционных названий (серная кислота, нитрат калия), специальных названий (вода, аммиак), а также исторически сложившихся тривиальных названий, которые используются в промышленности и в быту.
Систематические названия составляют из слов, специально созданных или выбранных для описания особенностей строения химических соединений.
Множительные приставки
N |
Приставка |
N |
Приставка |
N |
Приставка |
1/2 |
геми- |
3 |
три- |
7 |
гепта- |
1 |
моно- |
4 |
тетра- |
8 |
окта- |
3/2 |
сексви- |
5 |
пента- |
9 |
нона- |
2 |
ди- |
6 |
гекса- |
10 |
дека- |
Приставку ² моно-² частот опускают, а неопределенное число атомов n обозначают приставкой ² поли-² .
Названия простых веществ совпадают, как правило, с названиями соответствующих элементов (Na – натрий, Br2 – бром, Xe – ксенон), исключения составляют модификационные вещества (C – углерод: уголь, алмаз, графит, карбин; O – кислород: кислород, озон). В названиях модификационных веществ указывается число атомов в молекуле (O3 – трикислород; Sn – полисера).
Названия одноатомных катионов по методу Штока составляются из группового слова катион в именительном падеже и русского названия катиона в родительном падеже. В конце указывается степень окисления римской цифрой в круглых скобках (Hg+ - катион ртути (I); Hg2+ - катион ртути (II)). В случае если данному элементу свойственен лишь один катион, то значение степени окисления можно не указывать.
Названия одноатомных анионов составляются из корня русского названия элемента и суффикса –ид с добавлением группового слова –ион (F- - фторид-ион; Cl- - хлорид-ион).
Для большинства элементов корни их русских названий совпадают с корнями латинских названий, за исключением:
Символ |
Названи |
Корень латинского слов |
Ag |
Серебро |
Аргент- |
As |
Мышьяк |
Арс- , арсен- |
Au |
Золото |
Аур- |
C |
Углерод |
Карб- , карбон- |
Cu |
Медь |
Купр- |
Fe |
Железо |
Ферр |
H |
Водород |
Гидр- , гидроген- |
Hg |
Ртуть |
Меркур- |
Mn |
Марганец |
Марган- |
N |
Азот |
Нитр- |
Ni |
Никель |
Никкол- |
O |
Кислород |
Окс- , оксиген- |
Pb |
Свинец |
Плюмб- |
S |
Сера |
Сульф- , тио- |
Sb |
Сурьма |
Стиб- |
Si |
Кремний |
Сил- , силиц- , силик- |
Sn |
Олово |
Станн- |
Многоатомные ионы имеют специальные названия.\
Формула |
Название |
C22- |
Ацетиленид-ион |
O3 |
Озонид-ион |
NH4+ |
Катион аммония |
N3 |
Азид-ион |
O22- |
Пероксид-ион |
NO+ |
Катион нитрозил |
NO2+ |
Катион нитроила |
HS- |
Гидросульфид-ион |
NO- |
Нитрозид-ион |
CN- |
Цианид-ион |
NH2- |
Амид-ион |
OH- |
Гидроксид-ион |
В химической формуле катион всегда ставится на первое место, а анион – на второе, или электроположительный элемент ставиться на первое, а электроотрицательный – на второе.
В химических формулах бинарных соединений, веществ состоящих из двух элементов, на первое место ставится элемент, который стоит левее в следующем эмпирическом ряду:
Rn, Xe, Kr, B, Si, С, As, P, H, Te, Se, S, At, I, Br, Cl, N, O, F,(XeF2, ClF3, SO2, H2Te; исключения: NH3, N2H4)
Данный эмпирический ряд учитывают при составлении формул соединений, содержащих один металл и разные неметаллы (MgIBr, MnO3F, WSBr4).
Бинарные соединения.
Оксиды: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Пероксиды: Na2O2, BaO2.
Супероксиды: KO2.
Озониды: KO3.
Галогениды: KBr, NaI, CaCl2, AlBr3.
Халькогениды: CdS, CS2, K2Te, P4S5.
Нитриды: V3N, Cl3N, Mg3N3, BN.
Азиды: LiN3, Pb(N3)2.
Фосфиды: Ca3P2, Fe3P, K2P5.
Карбиды: CaC2, Al4C3, Be2C, Cr23C6.
Гидриды: CaH2, FeH2, LiH, (BeH2)n.
В химических формулах интерметаллидов, веществ включающих два и более металлов, первым указывается элемент стоящий левее в длиннопериодном варианте таблицы Менделеева (Mg2Sn2, NaMgF3, KAl(SO4)2). Если металлы стоят в одной группе, первым указывается элемент с большим порядковым номером (KNa2, AuCu3, KNaSO4).
Название сложного вещества по формуле читают справа налево двумя способами:
Формула |
Метод Штока |
Метод численных приставок |
FeCl2 |
Хлорид железа (II) |
Дихлорид железа |
FeCl3 |
Хлорид железа (III) |
Трихлорид железа |
CO |
Оксид углерода (II) |
Моноксид углерода |
CO2 |
Оксид углерода (IV) |
Диоксид углерода |
I2Cl6 |
Хлорид иода (VI) |
Гексахлорид дииода |
Неорганические кислоты делятся на кислородосодержащие (оксокислоты; HNO3, H2SO4, H3PO4) и бескислородные (HCl, H2S, HN3). Оксокислоты имеют общую формулу HxAyOz, где AyOzx- - анион (кислотный остаток), A – кислотообразующий элемент.
Систематическое название кислоты определяют названием ее аниона. В названии аниона вначале указывают атомы кислорода (-оксо-), а затем – кислотообразующего элемента с добавлением суффикса –ат.
Например: угольная кислота (H2CO3) – триоксокарбонат (IV) водорода; серная кислота (H2SO4) – тетраоксосульфат (VI) водорода.Основность кислоты определяется числом атомов водорода, способных замещаться на металл.
Одноосновные – HNO3, HCl; двухосновные – H2SO4, H2S; трехосновные – H3PO4; четырехосновные – H4P2O7.
В традиционных названиях оксокислот для обозначения степени окисления элемента A применяют суффиксы.
Суффиксы оксокислот.
Степеньокисления (с.о.) |
Суффикс |
Высшая или единственная |
-н-, -ов-, -ев-. |
Промежуточная (+5,+6) |
-новат- |
Промежуточная (+3,+4) |
-(ов)ист- |
Низшая (+1) |
-новатист- |
HСlO4 – хлорная к-та (с.о.=+7); HClO3 – хлорноватая к-та (с.о.=+5); HClO2 – хлористая к-та (с.о.=+3); HClO – хлорноватистая к-та (с.о.=+1).
Орто- и метакислоты: H3PO4 – ортофосфорная к-та; HPO3 – метафосфорная к-та; H2TeO4 – метателлуровая к-та; H6TeO6 – Ортотеллуровая к-та.
Пероксокислоты представляют собой пероксидные аналоги оксокислот, содержащих группу -O–O- (H2SO3(O2) – пероксисерная к-та).
Изополикислоты содержат два и более атома кислотообразующего элемента: дифосфорная к-та (H4P2O7) – гептаоксодифосфат (V) водорода; дисерная к-та (H2S2O7) – гептаоксодисульфат (VI) водорода.
Традиционные названия оксоанионов составляются из префикса и суффикса, обозначающих степени окисления элемента А.
Префиксы и суффиксы оксоанионов.
Степень окисления (с.о.) |
Префикс |
Суффикс |
Высшая |
Пер- |
-ат- |
Любая единственная или следующая за высшей |
- |
-ат- |
Промежуточная (+3,+4) |
- |
-ит- |
Низшая |
Гипо- |
-ит- |
Гидроксиды имеют общую формулу A(OH)x.
Щелочи гидроксиды щелочных (IА группа) и щелочно-земельных (IIА группа) металлов, растворимые в воде.
Систематические названия: LiOH – гидроксид лития, Fe(OH)3 – гидроксид железа (III).
Двойные соли содержат два катиона (KAl(SO4)2). Смешанные соли содержат два аниона (CaOCl2).
Систематические названия солей: сульфат калия (K2SO4) – тетраоксосульфат (VI) калия; сульфит натрия (Na2SO3) – триоксосульфат (IV) натрия; тригидродифосфат калия (KH3P2O7) – гептаоксодифосфат (V) водорода-калия.
Кристаллогидраты – кристаллические гидраты Ч определенного состава (Na2CO3Ч 10H2O – декагидрат карбоната натрия).
Названия минеральных кислот и соответствующих солей.
Х/ф кислоты |
Традиционное название кислоты |
Традиционное название соответствующей соли |
HAlO2 |
Метаалюминиевая |
Метаалюминат |
H3As |
Арсин |
Арсенид |
HAsO2 |
Метамышьяковистая |
Метаарсенит |
HAsO3 |
Метамышьяковая |
Метаарсенат |
H3AsO3 |
Ортомышьяковистая |
Ортоарсенит |
H3AsO4 |
Ортомышьяковая |
Ортоарсенат |
HBO2 |
Метаборная |
Метаборат |
H2B4O7 |
Четырехборная |
Тетраборат |
H3BO3 |
Ортоборная |
Ортоборат |
HBiO3 |
Висмутовая |
Висмутат |
HBr |
Бромоводород |
Бромид |
HBrO |
Бромоватистая |
Гипобромид |
HBrO3 |
Бромоватая |
Бромат |
HBrO4 |
Бромная |
Пербромат |
HCN |
Циановодород |
Цианид |
H2CO3 |
Угольная |
Карбонат |
HCl |
Хлороводород (Соляная) |
Хлорид |
HClO |
Хлорноватистая |
Гипохлорид |
HClO2 |
Хлористая |
Хлорит |
HClO3 |
Хлорноватая |
Хлорат |
HClO4 |
Хлорная |
Перхлорат |
HCrO2 |
Метахромистая |
Метахромит |
H2Cr2O7 |
Хромовая |
Хромат |
HF |
Фтороводород (Плавиковая) |
Фторид |
HFeO2 |
Железистая |
Феррит |
H2FeO4 |
Железная |
Феррат |
H2GeO3 |
Германиевая |
Германат |
HI |
Иодоводород |
Иодид |
HIO |
Иодоватистая |
Гипоиодит |
HIO3 |
Иодноватая |
Иодат |
HIO4 |
Иодная |
Периодат |
HMnO4 |
Марганцовая |
Перманганат |
H2MnO4 |
Марганцовистая |
Манганат |
H2MoO4 |
Молибденовая |
Молибдат |
HN3 |
Азидоводород (Азотистоводородная) |
Азид |
HNO2 |
Азотистая |
Нитрит |
HNO3 |
Азотная |
Нитрат |
HPO3 |
Метафосфорная |
Метафосфат |
H2P2O7 |
Двуфосфорная (Пирофосфорная) |
Дифосфат (Пирофосфат) |
H3PO2 |
Фосфорноватистая |
Гипофосфит |
H3PO3 |
Фосфористая |
Фосфит |
H3PO4 |
Ортофосфорная (Фосфорная) |
Ортофосфат (Фосфат) |
HReO4 |
Рениевая |
Перренат |
H2S |
Сероводород |
Сульфид |
HSCN |
Родановородод |
Роданид |
H2SO3 |
Сернистая |
Сульфит |
H2SO4 |
Серная |
Сульфат |
H2S2O3 |
Тиосерная |
Тиосульфат |
H2S2O7 |
Двусерная (Пиросерная) |
Двусульфат (Пиросульфат) |
H2S2O8 |
Пироксодвусерная (Надсерная) |
Пироксодисульфат (Персульфат) |
H2S4O6 |
Тетратионовая |
Политионат |
H2Se |
Селеноводород |
Селенид |
H2SeO3 |
Селенистая |
Селенит |
H2SeO4 |
Селеновая |
Селенат |
H2SiF6 |
Гексафторкремниевая (Кремнефтористоводородная) |
Кремнефторид (Фторсиликат) |
H2SiO3 |
Кремниевая |
Силикат |
H2SnO2 |
Олованистая |
Станнит |
H2Te |
Теллуроводород |
Теллурид |
H2TeO4 |
Теллуровая (Метателлуровая) |
Теллурат |
H6TeO6 |
Ортотеллуровая |
Ортотеллурат |
H2UO4 |
Урановая |
Уранат |
H2U2O7 |
Двуурановая |
Двууранат |
HVO3 |
Ванадиевая |
Ванадат |
H2WO4 |
Вольфрамовая |
Вольфрамат |
5. Общее представление об атоме: Первая модель атома появилась в 1904 году автором является Дж. Томсон, который представил атом, как схему "кекс с изюмом"
Затем Резерфорд создал "планетарную модель"
1. В центре атома находится положительно заряженная частица ядро, которое имеет массовый размер и содержит почти всю массу атома.
2. вокруг ядра по круговым орбиталям вращаются электроны. Но и эта модель имела свои недостатки:
а) не объясняет устойчивость атома
б) не объясняет линейчитость
Нильс Энгор создал ещё одну теорию: его квантовая модель базировалась на квантовой теории света и на законах классического механизма, а именно:
а) на постулате Планка - лучистая энергия испускающая
или поглощающие дискретно (отдельными порциями)
б) на принципе Эйнштейна, который утверждал, что световая энергия сущ. только в квантах.
Постулаты:
1. Электроны в атомах движутся не по любым орбитам, а по определенным стационарным, двигаясь по которым электрон не излучает и не поглощает энергию.
2.
Излучение или поглощение энергии
происходит при скачкообразным переходе
с одной орбиты на другую со спусканием
или поглощением кванта света.
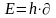
h - постоянная Планка
 - световая частота
- световая частота
Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов.
Элементарные частицы атома:
Электро́н — стабильная, отрицательно заряженная элементарная частица, одна из основных структурных единиц вещества. (-1,6*10^-19 Кл)
Протон – элементарная положительно заряженная частица.(1,6*10^-19 Кл)
Нейтро́н — элементарная частица, не имеющая электрического заряда.
Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом.
Изото́пы — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа.
Изоба́ры — нуклиды разных элементов, имеющие одинаковое массовое число.
№6.
Поведение электрона в атоме.
Три основные особенности поведения электронов в атоме:
1. Энергия свободного электрона, так же как и энергия тела, может изменяться непрерывно, но энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения.Таким образом, электрон в атоме может находиться только во вполне определенных состояниях.При переходе электрона из одного состояния в другое энергия поглощается или выделяется порциями – квантами энергии. Поэтому первая особенность поведения электрона часто называется принципом квантования его энергии. Эта особенность была постулирована датским физиком Нильсом Бором в 1913 году и в дальнейшем получила блестящее экспериментальное подтверждение.
2. Электрон в одних случаях проявляет свойства частицы вещества, а в других – волновые свойства. Такая двойственность поведения электрона и других микрочастиц (дуализм) – одно из общих свойств материи (и вещества, и поля). Оно называется "корпускулярно-волновой дуализм" или "дуализм волна-частица ". Волновые свойства электрона проявляются, например, при прохождении потока электронов через тончайшую кристаллическую пленку. Поток электронов ведет себя так, как будто через эту пленку прошли волны, то есть, подвергается дифракции (огибание волнами встречающегося на их пути препятствия ,если его размер сопоставим с длиной волны) и интерференции (увеличение гребней и уменьшение впадин волн при наложении их друг на друга). Эту особенность поведения электрона предсказал французский физик Луи де Бройль в 1924 году, а в 1926 году американский физик Клинтон Девиссон впервые наблюдал дифракционную картину при взаимодействии потока электронов с металлами. В настоящее время волновые свойства электронов широко используются при исследовании строения различных веществ.
3. Чем с большей точностью определяют положение электрона в пространстве, тем с меньшей точностью можно определить его скорость. И наоборот, чем с большей точностью определяют скорость электрона (абсолютную величину и направление), тем с меньшей точностью можно определить его положение в пространстве. Это утверждение, а оно справедливо и для других микрочастиц, называется "принцип неопределенностей". Этот принцип был сформулирован немецким физиком Вернером Гейзенбергом в 1927 году. Принцип неопределенностей "лишает "летящий электрон траектории. Действительно, если мы в какой-то момент точно знаем положение электрона, то мы принципиально ничего не знаем о его скорости и в следующий момент времени можем обнаружить электрон в любой другой точке атома, правда, с разной вероятностью.
Уравнение Луи Де Бройля:
λ=h/(m*c)- волновое уравнение де Бройля
λ-длина волны(м)
h-постоянная Планка (6,6*10^-34 Дж*с)
m-масса
c-скорость света(3*10^8 м/с)
Принцип неопределенности Гейзенберга:
нельзя одновременно с одинаковой точностью определить местоположение частицы и ее скорость, можно только указать вероятность, с которой частица будет находиться в области пространства вблизи ядра.
Понятие о волновой функции:
Волнова́я
фу́нкция,
или пси-функция ![]() — комплекснозначная
функция,
используемая в квантовой
механике для
описаниячистого
состояния системы.
Является коэффициентом разложения вектора
состояния по
базису (обычно координатному)
— комплекснозначная
функция,
используемая в квантовой
механике для
описаниячистого
состояния системы.
Является коэффициентом разложения вектора
состояния по
базису (обычно координатному)
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке конфигурационного пространства в данный момент времени считается равнойквадрату абсолютного значения волновой функции этого состояния в координатном представлении.
Уравнение Шредингера:
НΨ=ЕΨ
Е-полная энергия электрона
Ψ-волновая функция электрона
Н-гамильтониан(оператор полной энергии системы)
№7.
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему. Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным.
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. С возрастающим главным квантовым числом возрастают радиус орбиты и энергия электрона. Главное квантовое число обозначается как n.
Наибольшее число электронов на энергетическом уровне, с учетом спина электрона определяется по формуле: N = 2n2
Орбитальное квантовое число (азимутальное) - определяет азимутальное распределение плотности вероятности локализации электрона в атоме, то есть форму электронного облака и определяет энергетический подуровень данного энергетического уровня.
Связано с n -главным (радиальным) квантовым числом соотношением: l = 0; 1; 2; … ; n – 1
Магни́тное ква́нтовое число́ — Магнитное квантовое число (m) характеризует ориентацию в пространстве орбитального момента количества движения электрона или пространственное расположение электронной орбитали.
Спин — собственный момент импульса (или магнитный момент) элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
Спиновое квантовое число — это квантовое число, определяющее величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т.е. её собственного (внутреннего) момента импульса.
№8.
Принцип Паули - В атоме не могут находиться два электрона, у которых все четыре квантовых числа совпадали бы. Следствие: на любой орбитали могут находиться максимум два электрона, причем их спины должны иметь противоположную ориентацию.
Строение электронных оболочек атомов определяется 4 квантовыми числами п, 1,т1 и ms, принципом Паули и учетом стремления электронов к нахождению на возможно минимальном энергетическом уровне. В зависимости от п — главного квантового числа, изменяющегося в порядке натурального ряда чисел, электроны располагаются в определенном слое, а в зависимости от l — побочного квантового числа — в подслое. Число l зависит от п и изменяется от 0 до п — 1. ml — магнитное (орбитальное) квантовое число изменяется от — l до + l, ms — спиновое магнитное квантовое число—может иметь значение либо , либо . В зависимости от l электроны имеют разл. конфигурацию своего облака. При l = 0, ml тоже = 0 и облако шарообразное. В таком состоянии электроны называют s-электронами. При l = 1, ml может быть --1 и +1, что означает ориентированность электронного облака и его форму, напоминающую в разрезе цифру 8, это — р-электроны. При l = 2, ml может быть —2, —1, +1, +2, что также означает ориентированность облака, но более сложной конфигурации в виде 2 перекрещивающихся восьмерок, это — d-электроны и т. д. В каждом состоянии s, p, d или f может находиться либо один, неспаренный, электрон с ms ½ или —½ или два, спаренные, с замкнутыми ms-спинмомеитами. В зависимости от s-, p-, d-состояния электроны могут образовать разл. связи: ненаправленные за счет s-электронов и направленные за счет р- и d-электронов. Последнее весьма важно, так как нередко определяет важнейший элемент строения хим. соединения — координационное число. Хим. связь образуется за счет спаривающихся или спаренных электронов.
№9.
способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Расшифровка электронной конфигурации
По историческим причинам в формуле электронной конфигурации квантовое число l записывается латинской буквой. Состояние с l = 0 обозначается буквой s, l = 1 — p, l = 2 — d, l = 3 — f, l = 4 — g и далее по алфавиту. Слева от числа l пишут число n, а сверху от числа l — число электронов в состоянии с данным n, l. Из-за практического удобства в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа n, а затем квантового числа l, например 1s22s22p63s23p2. Поскольку такая запись несколько избыточна, иногда формулу сокращают до 1s22s2p63s2p2, т. е. опускают число n там, где его можно угадать из правила упорядочения термов.
Правило Гунда (Хунда) определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Гундом (Хундом) в 1927 г. на основе анализа атомных спектров. Согласно правилу Гунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
№10.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d...
Правило Клечковского — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах. Порядок заполнения электронов в атоме происходит в порядке возрастания n+l. При одинаковой сумме раньше заполняются электроны с меньшим значением n.
Принцип наименьших энергий. Электронное заполнение по уровням и подуровням от наименьших по энергии к наибольшим по энергии т.е от меньшего значения n+l к большему значению n+l . При одинаковых значениях суммы вперед заполняется подуровень с наименьшим значением n.
Формулировка правила Клечковского
Эта энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951-м году В. М. Клечковским и иногда называемого правилом (n+l). Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы (n+l). Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы (n+l), причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа n; например, при (n+l)=6 орбитальные энергии подчиняются последовательности 4d<5p<6s, так как здесь для d-орбитали главное квантовое число наименьшее (n=4), для s-орбитали — наибольшее (n=6), р-орбиталь занимает промежуточное положение (n=5).
При заполнении атомных орбиталей электронами соблюдаются три основные правила:
Принцип устойчивости. АО заполняются электронами в порядке повышения их энергетических уровней:
1s < 2s < 2p < 3s < 3p < 4s < 3d ...
Принцип Паули. На одной АО могут находиться не более двух электронов с противоположными спинами.
Правило Хунда. На АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны располагаются по одному с параллельными спинами
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства):
1. s-Элементы; заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы; заполняется электронами p-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме I и VII).
3. d-Элементы; заполняется электронами d-подуровень, второго снаружи уровня, а на внешнем уровне остается один или два электрона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и p-элементами (их также называют переходными элементами). 4. f-Элементы; заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической "системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
№11.
Электронная структура атомов. Электронам в атоме приписываются различные орбитали, которые характеризуются главным квантовым числом n, орбитальным квантовым числом l и магнитным квантовым числом ml. Имеется одна наиболее устойчивая орбиталь с n = 1, образующая К-оболочку. L-Оболочка с n = 2 включает одну орбиталь с l = 0 и ml = 0 и три с l = 1 и ml = -1, 0 и +1. Их называют 1s-орбиталь, 2s-орбиталь и три 2р-орбитали. М-Оболочка состоит из 3s-орбитали, трёх 3р-орбиталей и пяти 3d-орбиталей. Электрон имеет спин со спиновым квантовым числом s = 1/2, который может ориентироваться относительно определённого направления двумя различными путями - с компонентами, даваемыми магнитным спиновым квантовым числом ms, равным + 1/2 или -1/2. В атоме не может быть двух электронов с одинаковыми значениями всех квантовых чисел. Следовательно, 1s-орбиталь, образующая К-оболочку, может быть занята только одним электроном с положительным или отрицательным спином или же двумя электронами (электронной парой), одним - с положительным спином, другим - с отрицательным. Заполнение определённых оболочек и подоболочек приводит к особой устойчивости атомов, наблюдающейся у атомов инертных газов.
Периодическая система представляет собой классификацию химических элементов в соответствии с периодическим законом, устанавливающим периодическое изменение свойств химических элементов по мере увеличения их атомной массы, связанного с увеличением заряда ядра их атомов; поэтому заряд ядра атома совпадает с порядковым номером элемента в периодической системе и называется атомным номером элемента. Периодическая система элементов оформляется в виде таблицы, в горизонтальных рядах которой – периодах – происходит постепенное изменение свойств элементов, а при переходе от одного периода к другому – периодическое повторение общих свойств; вертикальные столбцы – группы – объединяют элементы со сходными свойствами..
№12.
Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). «…свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра их атомов. Исключений из закона в его современной формулировке нет. Была вскрыта причина периодичности: свойства химических элементов изменяются с возрастанием порядкового номера (заряда ядер) периодически потому, что периодически изменяется число электронов в наружном слое атома. Повторяемость сходных электронных структур приводит к повторяемости свойств элементов. Периодическая система элементов – графическое (табличное) выражение периодического закона
№13.
Структура периодической системы элементов
Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство.
Номер группы в Периодической системе определяет число валентных электронов а атомах элементов. Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня
Порядок формирования периодов связан с постепенным заселением энергетических подуровней электронами. Последовательность заселения определяется принципом минимума энергии, принципом Паули и правилом Гунда.
Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.Чтобы определить, какая подгруппа — главная, а какая — побочная, важно помнить, что в состав главных подгрупп входят элементы как малых, так и больших периодов. Побочные подгруппы образованы только элементами больших периодов. Побочная подгруппа начинается с элемента четвертого (большого) периода — цинка Zn. И еще одно отличие: главная подгруппа, как правило, состоит из большего числа элементов, чем побочная (в VIII группе наоборот).
№14.
Энергия ионизации - минимальная энергия, необходимая для удаления электрона из атома на бесконечность в соответствии с уравнением Х = Х+ + е−
Ее значения известны для атомов всех элементов Периодической системы
На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
1. эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
2. радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации электрона;
3. мера проникающей способности этого электрона;
4. межэлектронное отталкивание среди наружных (валентных) электронов.
При движении слева направо по периоду энергия ионизации постепенно увеличивается, при увеличении порядкового номера в пределах группы - уменьшается. Минимальные первые потенциалы ионизации имеют щелочные металлы, максимальные - благородные газы.
Для одного и того же атома вторая, третья и последующие энергии ионизации всегда увеличиваются, так как электрон приходится отрывать от положительно заряженного иона.
Последовательность отрыва электронов - обычна обратная последовательности заселения орбиталей электронами в соответствии с принципом минимума энергии. Однако элементы, у которых заселяются d-орбитали, являются исключениями - в первую очередь они теряют не d-, а s-электроны.
