
- •Экзаменационные ответы. Молекулярная физика. Термодинамика
- •1) Молекулярно-кинетическая теория идеальных газов – основные положения и уравнения состояния. Равновесные состояния и процессы. Абсолютный ноль.
- •2) Максвелловское распределение молекул по скоростям. Больцмановское разделение молекул в потенциальном поле. Барометрическая формула.
- •3) Явление переноса: диффузии, теплопроводности и внутреннего трения.
- •4) Первое начало термодинамики. Применение первого начала термодинамики к различным изопроцессам. Адиабатный и политропный процессы.
- •5) Обратимые и необратимые процессы. Круговые процессы. Цикл Карно. Энтропия как функция состояния. Второе и третье начала термодинамики.
- •6) Силы и потенциальная энергия межмолекулярного взаимодействия. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние вещества. Внутренняя энергия реального газа.
- •7) Теплоемкость многоатомных газов. Зависимость теплоемкости от вида процесса. Недостаточность классической теории теплоемкости.
- •9) Фазовые равновесия и фазовые превращения. Фазовая диаграмма. Тройная точка. Уравнение Клайперона-Клаузиса.
- •10) Фазовые переходы.
9) Фазовые равновесия и фазовые превращения. Фазовая диаграмма. Тройная точка. Уравнение Клайперона-Клаузиса.
Фазовое равновесие, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства температуры всех частей системы (термическое равновесие), равенства давления во всем объеме системы (механическое равновесие) и равенство химических потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние температуры и давления, n = 2), и числом термодинамических степеней свободы v уравнением: v = k + 2 – f.
К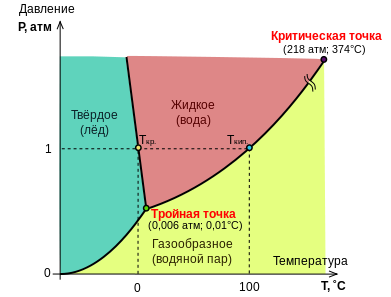 аждое
вещество в зависимости от внешних
условий - температуры и давления - может
находиться в твердом, жидком и газообразном
состоянии. При подводе или отводе теплоты
меняется форма связи между молекулами,
вызывая тем самым изменение вещества,
т. е. происходит фазовое превращение.
Для получения холода используют фазовые
превращения, протекающие при низких
температурах с поглощением теплоты из
охлаждаемой среды. К ним относятся
плавление, кипение и сублимация.
аждое
вещество в зависимости от внешних
условий - температуры и давления - может
находиться в твердом, жидком и газообразном
состоянии. При подводе или отводе теплоты
меняется форма связи между молекулами,
вызывая тем самым изменение вещества,
т. е. происходит фазовое превращение.
Для получения холода используют фазовые
превращения, протекающие при низких
температурах с поглощением теплоты из
охлаждаемой среды. К ним относятся
плавление, кипение и сублимация.
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов.
Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением
![]()
где ![]() —
удельная теплота фазового перехода,
—
удельная теплота фазового перехода, ![]() —
изменение удельного объёма тела при
фазовом переходе.
—
изменение удельного объёма тела при
фазовом переходе.
10) Фазовые переходы.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Наиболее распространённые примеры фазовых переходов первого рода:
плавление и кристаллизация
испарение и конденсация
сублимация и десублимация
