
- •Экзаменационные ответы. Молекулярная физика. Термодинамика
- •1) Молекулярно-кинетическая теория идеальных газов – основные положения и уравнения состояния. Равновесные состояния и процессы. Абсолютный ноль.
- •2) Максвелловское распределение молекул по скоростям. Больцмановское разделение молекул в потенциальном поле. Барометрическая формула.
- •3) Явление переноса: диффузии, теплопроводности и внутреннего трения.
- •4) Первое начало термодинамики. Применение первого начала термодинамики к различным изопроцессам. Адиабатный и политропный процессы.
- •5) Обратимые и необратимые процессы. Круговые процессы. Цикл Карно. Энтропия как функция состояния. Второе и третье начала термодинамики.
- •6) Силы и потенциальная энергия межмолекулярного взаимодействия. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние вещества. Внутренняя энергия реального газа.
- •7) Теплоемкость многоатомных газов. Зависимость теплоемкости от вида процесса. Недостаточность классической теории теплоемкости.
- •9) Фазовые равновесия и фазовые превращения. Фазовая диаграмма. Тройная точка. Уравнение Клайперона-Клаузиса.
- •10) Фазовые переходы.
6) Силы и потенциальная энергия межмолекулярного взаимодействия. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние вещества. Внутренняя энергия реального газа.
Ван-дер-Ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие сопытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для
более точного описания поведения
реальных газов при низких температурах
была создана модель газа Ван-дер-Ваальса,
учитывающая силы межмолекулярного
взаимодействия. В этой модели внутренняя
энергия ![]() становится
функцией не только температуры,
но и объёма.
становится
функцией не только температуры,
но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием[1].
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
где
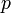 — давление,
— давление,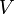 — молярный
объём,
— молярный
объём,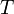 —
абсолютная температура,
—
абсолютная температура, — универсальная
газовая постоянная.
— универсальная
газовая постоянная.
Критическое состояние – состояние, при котором исчезает различие между жидкостью и газом. А температура, при которой система находится в критическом состояний, называют критической.
Внутренняя энергия реального газа будем определяться суммой кинетической энергии Eк теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - Eп:
U=Eк+Eп.
Um=CvT-(a/Vm)
Из формулы для внутренней энергии реального газа следует, что его внутренняя энергия растет как с увеличением температуры, так и с увеличением объема. Если реальный газ будет расширяться или сжиматься адиабатически и без совершения внешней работы, то для него, согласно первому началу термодинамики:
ΔQ=ΔU+ΔA; ΔQ=0, ΔA=0; ⇒ ΔU=0 → U=const,
