
- •Экзаменационные ответы. Молекулярная физика. Термодинамика
- •1) Молекулярно-кинетическая теория идеальных газов – основные положения и уравнения состояния. Равновесные состояния и процессы. Абсолютный ноль.
- •2) Максвелловское распределение молекул по скоростям. Больцмановское разделение молекул в потенциальном поле. Барометрическая формула.
- •3) Явление переноса: диффузии, теплопроводности и внутреннего трения.
- •4) Первое начало термодинамики. Применение первого начала термодинамики к различным изопроцессам. Адиабатный и политропный процессы.
- •5) Обратимые и необратимые процессы. Круговые процессы. Цикл Карно. Энтропия как функция состояния. Второе и третье начала термодинамики.
- •6) Силы и потенциальная энергия межмолекулярного взаимодействия. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние вещества. Внутренняя энергия реального газа.
- •7) Теплоемкость многоатомных газов. Зависимость теплоемкости от вида процесса. Недостаточность классической теории теплоемкости.
- •9) Фазовые равновесия и фазовые превращения. Фазовая диаграмма. Тройная точка. Уравнение Клайперона-Клаузиса.
- •10) Фазовые переходы.
5) Обратимые и необратимые процессы. Круговые процессы. Цикл Карно. Энтропия как функция состояния. Второе и третье начала термодинамики.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Круговой процесс — процесс, при котором газ, пройдя через ряд состояний, возвращается в исходное.
Цикл Карно — круговой процесс, состоящий из двух изотерм и двух адиабат.
![]()
Цикл Карно состоит из четырёх стадий:
Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру
 ,
то есть температуру нагревателя. Затем
тело приводится в контакт с нагревателем,
который изотермически (при постоянной
температуре) передаёт ему количество
теплоты
,
то есть температуру нагревателя. Затем
тело приводится в контакт с нагревателем,
который изотермически (при постоянной
температуре) передаёт ему количество
теплоты 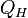 .
При этом объём рабочего тела увеличивается.
.
При этом объём рабочего тела увеличивается.Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру
 ,
приводится в контакт с холодильником
и начинает изотермически сжиматься,
отдавая холодильнику количество
теплоты
,
приводится в контакт с холодильником
и начинает изотермически сжиматься,
отдавая холодильнику количество
теплоты 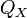 .
.Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.

Энтропия — функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю.
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
