
- •Введение
- •Преобразование энергии в энергетических установках
- •Классификация судов по типам сэу
- •Глава 1. История развития и современность судовых энергетических установок
- •Первые пароходы
- •Начало промышленного пароходостроения
- •Суда с паротурбинными установками (пту)
- •Суда с двигателями внутреннего сгорания (двс)
- •Суда с газотурбинными установками (гту)
- •Суда с ядерными энергетическими установками (яэу)
- •Глава 2. Термодинамика
- •Общая схема преобразования тепла в работу
- •Термодинамическое рабочее тело и его параметры
- •Уравнение состояния идеального газа
- •Термодинамический процесс, термодинамическая система координат. Графическое изображение состояния рабочего тела и термодинамических процессов
- •Равновесные и неравновесные процессы. Виды равновесных процессов
- •Законы идеального газа (газовые законы)
- •Теплоемкость
- •Первый закон термодинамики
- •Анализ термодинамических газовых процессов
- •Круговые процессы (циклы)
- •Запись первого закона термодинамики для прямых и обратных циклов
- •Величины, характеризующие прямые и обратные циклы
- •Цикл Карно
- •Обратимые и необратимые процессы. Второй закон термодинамики
- •Глава 3. Поршневые двигатели внутреннего сгорания (двс)
- •Принципиальная схема двигателя внутреннего сгорания
- •Основные определения двс
- •Классификация судовых двс
- •Маркировка
- •Принцип действия четырехтактного двигателя
- •Принцип действия двухтактного двигателя
- •- Выпускной клапан
- •Циклы поршневых двс
- •Наддув дизелей
- •Показатели работы двс
- •Конструктивное исполнение судовых двс
- •- Цилиндровая втулка; 5 - крышка цилиндра; 6 - блок-картер
- •Состав и свойства топлив, применяемых в двс
- •Смазочные материалы для двс
- •Глава 4. Паротурбинные, газотурбинные и ядерные энергетические установки. Судовые котлы
- •Принцип действия турбин
- •Паротурбинные установки (пту)
- •Газотурбинные установки (гту)
- •Ядерные энергетические установки (яэу)
- •Главные и вспомогательные котлы
- •Глава 5. Судовые системы
- •Система смазки
- •5. 2. Система охлаждения
- •Топливная система
- •Система сжатого воздуха
- •Система газовыпуска
- •Осушительная, балластная и противопожарная системы
- •Система вентиляции и кондиционирования воздуха
- •Система отопления
- •Глава 6. Передачи и валопровод 6.1. Передачи
- •Валопровод
- •Глава 7. Основы проектирования судовых энергетических установок
- •Общие требования и рекомендации
- •Расположение машинно-котельного отделения (мко) на судне и размещение в нем основного механического оборудования
- •Вопросы для итогового контроля
- •Масляная судовая система - назначение, принципиальная схема.
- •Судовая система охлаждения - назначение, принципиальная схема.
- •Система сжатого воздуха - назначение, принципиальная схема.
- •Библиографический список
- •Оглавление
- •Глава 1. История развития и современность судовых
- •Глава 2. Термодинамика 20
- •Глава 3. Поршневые двигатели внутреннего сгорания (двс)... 48
Поршень действует
на газ с силой
Fn
= mg,
тогда потенциальная
энергия поршня (источника внешнего
давления)
W~пот
= mgy
= yFn.
В то же время газ
действует на поршень с силой
Fгаз
= PSn,
2
где P
- давление газа, Па; Sn
- площадь нижней поверхности поршня, м
. Согласно третьему закону Ньютона
Fn
Fгаз.
Тогда потенциальная
энергия внешнего источника давления
Wпот
yFn
yPSn.
Поскольку объем
газа, заключенного в рассматриваемый
цилиндр, V'газ
= ySn,
то w
= pv
пот газ
Таким образом,
выражение для полной энергии газа в
цилиндре можно записать:
E
= U
+ Жпот
= U
+ PVza3.
Величина H,
равная сумме внутренней энергии и
произведения давления системы на
величину объема системы (H=E
= U+PVW),
- называется энтальпией. Также используется
понятие удельной массовой энтальпии:
h
= H,
m
где т
- масса тела, кг.
Первый закон
термодинамики, выраженный через
энтальпию:
dq
= dh - vdp.
Основываясь на
изученном материале, проанализируем
термодинамические газовые процессы
в следующем порядке: 1) условие протекания
процесса;
уравнение процесса;
3) график процесса в координатах p
- v; 4) связь параметров;
5) определение изменения внутренней
энергии Аи; 6) определение работы
Al;
7) определение теплоты Aq;
8) частная запись первого закона
термодинамики для рассматриваемого
процесса.
Изохорный процесс
(V = const)
Условие протекания
процесса: v
= const.
Уравнение процесса:
v
= const илиp
/ T
= const (закон Шарля).
Анализ термодинамических газовых процессов
5 |
6 |
|
• |
3 |
4 |
|
|
1 |
2 |
|
• |
v
Рис. 2.14. График
изобарного процесса 38
2
AU1-2
= jcvdT
=
cv(2
-T1).
T1
Определение работы:
2
Al1-2
= jpdv
=
p(v2
- v1)
= R(T2
- T1)
.
Согласно уравнению
Роберта Майера
cp
- cv
= R, тогда Aq1-2
= cp(T2
-T1).
Частная запись
первого закона термодинамики для
изобарного процесса:
dq
=
dh.
Изотермический
процесс
Условие протекания
процесса: T
= const.
Уравнение
изотермического процесса: pv
= const или pv
= RT.
График процесса
(рис. 2.15):
Р
i
v
Рис. 2.15. График
изотермического процесса
Связь параметров:
на основании закона Бойля - Мариотта
P2
v1
-.2
= или P1V1
= P2V2
= P3V3....
P1
v2
P
Определение
внутренней энергии:
T2
T1


![]()
|
5/2R |
cv |
3/2R |
|
7/2R |
cv |
5/2R |
s |
8/2 R |
cv |
6/2R |
= 1,4;
1,33.
График процесса
(рис. 2.16):
Рис. 2.16. График
адиабатного процесса
4. Связь параметров:
к-1
f
Р2 ^ &
T2
Ti
p1
v
2
, или —
v
'Р2
V1
Pi J
, или T2
, или Tr-
T1
v2
J
к-1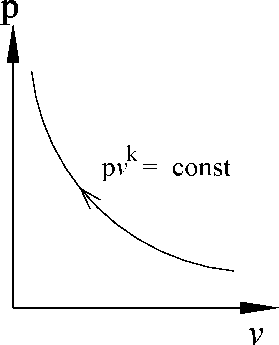
Определение
внутренней энергии:
AU1-2
= jcvdT
= cv(T2
-T1).
Определение работы:
Л,
v}
1 RT1
Al1-2
= j pdv
=
y-k
k
-1
( P Л
k 2
цесса:
Определение теплоты:
Aq1-2
= 0.
Частная запись
первого закона термодинамики для
адиабатного про-
Aq1-2
= AU1-2
+ Al1-2; поскольку
Aq1-2
= 0, Au = -Al.
Политропные
процессы
Условие протекания
политропного процесса: может протекать
во всех направлениях.
Уравнение процесса:
pvn
= const, где п
- показатель политропы. При этом n
= (c - cp)
/ (c - cv),
где с
- теплоемкость газа в политропном
процессе.
Политропные процессы
являются общими
процессами, и ранее рассмотренные
процессы являются их частными случаями:
а) при п
= 0
р
= const - изобарный процесс;
б) при п
= 1 pv
= const или T
= const - изотермический
процесс;
в) при n
= k
pvk
= const - адиабатный процесс;
г) при n
= да pv”
= const или rfpv
= const,
тогда v = const
- изохорный
процесс.
График процесса
(рис. 2.17):
V
Рис. 2.17. Примеры
графиков политропных процессов

