- •Введение
- •Преобразование энергии в энергетических установках
- •Классификация судов по типам сэу
- •Глава 1. История развития и современность судовых энергетических установок
- •Первые пароходы
- •Начало промышленного пароходостроения
- •Суда с паротурбинными установками (пту)
- •Суда с двигателями внутреннего сгорания (двс)
- •Суда с газотурбинными установками (гту)
- •Суда с ядерными энергетическими установками (яэу)
- •Глава 2. Термодинамика
- •Общая схема преобразования тепла в работу
- •Термодинамическое рабочее тело и его параметры
- •Уравнение состояния идеального газа
- •Термодинамический процесс, термодинамическая система координат. Графическое изображение состояния рабочего тела и термодинамических процессов
- •Равновесные и неравновесные процессы. Виды равновесных процессов
- •Законы идеального газа (газовые законы)
- •Теплоемкость
- •Первый закон термодинамики
- •Анализ термодинамических газовых процессов
- •Круговые процессы (циклы)
- •Запись первого закона термодинамики для прямых и обратных циклов
- •Величины, характеризующие прямые и обратные циклы
- •Цикл Карно
- •Обратимые и необратимые процессы. Второй закон термодинамики
- •Глава 3. Поршневые двигатели внутреннего сгорания (двс)
- •Принципиальная схема двигателя внутреннего сгорания
- •Основные определения двс
- •Классификация судовых двс
- •Маркировка
- •Принцип действия четырехтактного двигателя
- •Принцип действия двухтактного двигателя
- •- Выпускной клапан
- •Циклы поршневых двс
- •Наддув дизелей
- •Показатели работы двс
- •Конструктивное исполнение судовых двс
- •- Цилиндровая втулка; 5 - крышка цилиндра; 6 - блок-картер
- •Состав и свойства топлив, применяемых в двс
- •Смазочные материалы для двс
- •Глава 4. Паротурбинные, газотурбинные и ядерные энергетические установки. Судовые котлы
- •Принцип действия турбин
- •Паротурбинные установки (пту)
- •Газотурбинные установки (гту)
- •Ядерные энергетические установки (яэу)
- •Главные и вспомогательные котлы
- •Глава 5. Судовые системы
- •Система смазки
- •5. 2. Система охлаждения
- •Топливная система
- •Система сжатого воздуха
- •Система газовыпуска
- •Осушительная, балластная и противопожарная системы
- •Система вентиляции и кондиционирования воздуха
- •Система отопления
- •Глава 6. Передачи и валопровод 6.1. Передачи
- •Валопровод
- •Глава 7. Основы проектирования судовых энергетических установок
- •Общие требования и рекомендации
- •Расположение машинно-котельного отделения (мко) на судне и размещение в нем основного механического оборудования
- •Вопросы для итогового контроля
- •Масляная судовая система - назначение, принципиальная схема.
- •Судовая система охлаждения - назначение, принципиальная схема.
- •Система сжатого воздуха - назначение, принципиальная схема.
- •Библиографический список
- •Оглавление
- •Глава 1. История развития и современность судовых
- •Глава 2. Термодинамика 20
- •Глава 3. Поршневые двигатели внутреннего сгорания (двс)... 48
Тогда
G1
= N1m1
V2
N2
m2
'
Согласно закону
Авогадро N1
= N2, тогда
G1
= m1
V2
m2
Отношение масс
молекул равно отношению молярных масс:
m1
= Ц1
Окончательно
получим:
m2
Ц2
V1
= ц1 V2 Ц2
т.е. отношение масс
разных идеальных газов, заключенных в
равных объемах и находящихся при равных
давлениях и температурах, равно отношению
молярных масс этих газов.
Из закона Авогадро
вытекают два важных следствия:
в 1
кмоле любого газа при любых параметрах
находится одинаковое
26 1
число частиц, равное
числу Авогадро NA
= 6,02 10 кмоль- ;
1
кмоль любого газа при нормальных
физических условиях занимает объем
22,4
м3.
Понятие теплоемкости
Количество
подведенного тепла прямо пропорционально
изменению температуры тела;
dq
~ dT
или dq
= cdT.
Отсюда находим
коэффициент пропорциональности,
называемый теплоемкостью:
dq
c =
——. dT
Теплоемкостью тела
называется количество тепла, необходимого
для нагрева тела на один градус.
Теплоемкость,
отнесенная к единице количества
вещества, называется удельной.
Существует три
способа задания теплоемкости по
количеству единицы вещества:
массовой
теплоемкостью называют количество
теплоты, необходимой для изменения
температуры единицы массы вещества
(например, 1кг)
на 1
градус;
Теплоемкость
мольной
теплоемкостью называют количество
теплоты, необходимой для изменения
температуры единицы количества вещества
(например, 1
моль) на 1
градус;
объемной
теплоемкостью называют количество
теплоты, необходимой для изменения
температуры единицы объема вещества
(например, 1
м ) на 1
градус.
Теплоемкость
рабочего тела при различных способах
подвода теплоты
Для газов и паров
величина теплоемкости зависит от
способа подвода тепла.
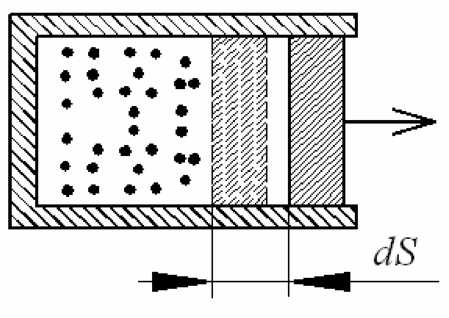
Адиабатный процесс
(рис. 2.5). Рассмотрим цилиндр с поршнем,
в котором находится газ. Поскольку
процесс адиабатный (т.е. процесс без
теплообмена с окружающей средой),
на рисунке изобразим теплоизоляцию.
Рис. 2.5 Адиабатный
процесс:
1 - изоляция; dS
- величина перемещения поршня
Поршень перемещается
на величину dS
. Если к телу не подводится тепло,
т.е. dq
= 0,
то при увеличении объема газ будет
расширяться и его температура будет
снижаться, т.е. dT
ф
0.
Можно записать:
С = dq
= _0_
= 0.
адиаб
i^Ti
i^ti
dT
dT
Адиабатная
теплоемкость тела равна 0.
Изохорный процесс
(рис. 2.6). Это процесс, который происходит
при
постоянном объеме:
V
= const.
Рис. 2.6. Изохорный
процесс: 1;
2 - жесткие крепления

В этом случае будем
считать, что поршень жестко закреплен,
не перемещается (dS
= 0), поэтому объем газа не изменяется.
К рабочему телу подводится (или отводится)
тепло, температура тела изменяется:
dq
ф
0 и dT
ф
0,
тогда
d%_
dT„
ф
0,
т.е. изохорная
теплоемкость cV
не равна 0.
Так как поршень не
перемещается, то работа не совершается,
а тепло при изохорном процессе идет
только на нагрев рабочего тела.
Изобарный процесс
(рис. 2.7). Это процесс, который происходит
при постоянном давлении: p
= const.
Рис. 2.7. Изобарный
процесс
Поршень перемещается
(dS
ф
0), к
рабочему телу подводится (или отводится)
тепло, температура тела изменяется:
dq
ф
0 и dT
ф
0,
тогда
cP
= ^ ф 0,
P
dTP
т.е. изобарная
теплоемкость ср
не равна 0.
В изобарном процессе
тепло идет на нагрев и на совершение
работы. В этом случае при нагреве тела
на одну и ту же величину (изобарный
нагрев) тепла необходимо подвести
больше, чем при изохорном, т.е. изобарная
теплоемкость ср
будет больше, чем изохорная cV.
Изотермический
процесс. Это процесс, который происходит
при постоянной температуре: T
= const.
В этом случае поршень
перемещается, осуществляется теплообмен
рабочего тела с окружающей средой,
однако температура тела не изменяется:
dq
ф
0 и dT
= 0,