
- •Субпопуляции т- Лимфоцитов
- •54. Антигены. Свойства. Антигенная структура бактериальной клетки. А нтигенны
- •73. Характеристика возбудителя пищевых токсикоинфекций- сальмонеллезов
- •74. Характеристика возбудителя ботулизма.
- •75. Характеристика стрептококка.
- •76. Туберкулез(Mycobacterium tuberculosis)
- •77. Дифтерия (Corynebacterium diphtheriae)
- •78. Коклюш (Bardatella pertussis)
- •Клиника трахомы
- •Осложнения трахомы
- •Диагностика трахомы
- •Дифференциальная диагностика трахомы и паратрахомы
- •Лечение трахомы
- •Профилактика трахомы
- •Патогенез хламидиоза
- •Клиника хламидиоза
- •Диагностика хламидиоза
- •Лечение хламидиоза
- •Микроскопическое исследование
- •Микологическое исследования
- •Серологическая диагностика
- •Биологическая проба
- •Кожные аллергические пробы
4. Вирусология — раздел микробиологии, изучающий вирусы (от латинского слова virus — яд).
Впервые существование вируса (как нового типа возбудителя болезней) доказал в 1892 году русский учёный Д. И. Ивановский. После многолетних исследований заболеваний табачных растений, в работе, датированной 1892 годом, Д. И. Ивановский приходит к выводу, что мозаичная болезнь табака вызывается «бактериями, проходящими через фильтр Шамберлана, которые, однако, не способны расти на искусственных субстратах». На основании этих данных были определены критерии, по которым возбудителей заболеваний относили к этой новой группе: фильтруемость через «бактериальные» фильтры, неспособность расти на искусственных средах, воспроизведения картины заболевания фильтратом, освобождённым от бактерий и грибов. Возбудитель мозаичной болезни называется Д. И. Ивановским по-разному, термин «вирус» ещё не был введён, иносказательно их называли то «фильтрующимися бактериями», то просто «микроорганизмами».
Пять лет спустя, при изучении заболеваний крупного рогатого скота, а именно — ящура, был выделен аналогичный фильтрующийся микроорганизм. А в 1898 году, при воспроизведении опытов Д. Ивановского голландским ботаником М. Бейеринком, он назвал такие микроорганизмы «фильтрующимися вирусами». В сокращённом виде это название и стало обозначать данную группу микроорганизмов.
В 1901 году было обнаружено первое вирусное заболевание человека — жёлтая лихорадка. Это открытие было сделано американским военным хирургом У. Ридом и его коллегами.
В 1911 году Фрэнсис Раус доказал вирусную природу рака — саркомы Рауса (лишь в 1966 году, спустя 55 лет, ему была вручена за это открытие Нобелевская премия по физиологии и медицине).
5. Разносторонне образованный, блестящий экспериментатор, член Французской медицинской академии, Л. Пастер сделал ряд выдающихся открытий. За короткий период с 1857 по 1885 г. он доказал, что брожение (молочнокислое, спиртовое, уксуснокислое) не является химическим процессом, а его вызывают микроорганизмы. Опроверг теорию самозарождения; открыл явление анаэробиоза, т.е. возможность жизни микроорганизмов в отсутствие кислорода. Заложил основы дезинфекции, асептики и антисептики; открыл способ предохранения от инфекционных болезней с помощью вакцинации.
Физиологический период в развитии Микробиологии связан также с именем немецкого ученого Роберта Коха, которому принадлежит разработка методов получения чистых культур бактерий, окраски бактерий при микроскопии, микрофотографии. Известна также сформулированная Р. Кохом триада Коха, которой до сих пор пользуются при установлении возбудителя болезни.
Работы Л. Пастера по вакцинации открыли новый этап в развитии микробиологии, по праву получивший название ''иммунологического».
П. Эрлих - немецкий химик, выдвинул гуморальную (от лат. humor - жидкость) теорию иммунитета. Он считал, что иммунитет возникает в результате образования в крови антител, которые нейтрализуют яд. Подтверждением этому было открытие антитоксинов - антител, нейтрализующих токсины у животных, которым вводили дифтерийный или столбнячный токсин (Э. Беринг, С. Китазато). Однако исследования И. И. Мечникова (1845 - 1916) показали, что большую роль в формировании иммунитета играют особые клетки, макро- и микрофаги. Эти клетки поглощают и переваривают чужеродные частицы, в том числе бактерии. Исследования И. И. Мечникова по фагоцитозу убедительно доказали, что, помимо гуморального, существует клеточный иммунитет. И. И. Мечников, ближайший помощник и последователь Л. Пастера, заслуженно считается одним из основоположников иммунологии. Его работы положили начало изучению иммунокомпетентных клеток как морфологической основы иммунной системы, ее единства и биологической сущности. Иммунологический период характеризуется открытием основных реакций иммунной системы на генетически чужеродные вещества (антигены): антителообразование и фагоцитоз/гиперчувствительность замедленного типа (ГЗТ), гиперчувствительность немедленного типа (ГНТ), толерантность, иммунологическая память. ГЗТ и ГНТ, две реакции, лежащие в основе аллергии (от греч. allos - другой и ergon - действие), т. е. болезней характеризующихся определенными клиническими симптомами, вследствие нетипичной, извращенной реакции на антиген. Аллергические реакции могут возникать, например, на сывороточные препараты, антибиотики, животные и растительные белки, домашнюю пыль, пух, шерсть и т.д.
6. Исследования И. И. Мечникова (1845—1916) показали, что большую роль в формировании иммунитета играют особые клетки — макро- и микрофаги. Эти клетки поглощают и переваривают чужеродные частицы, в том числе бактерии. Исследования И. И. Мечникова по фагоцитозу убедительно доказали, что, помимо гуморального, существует клеточный иммунитет. И. И. Мечников, ближайший помощник и последователь Л. Пастера, заслуженно считается одним из основоположников иммунологии. Его работы положили начало изучению иммунокомпетентных клеток как морфологической основы иммунной системы, ее единства и биологической сущности.
Д.И.Ивановский (1864— 1920) открыл вирусы — представителей царства vira. Один из основоположников вирусологии. Впервые открыл проходящий через бактериологические фильтры возбудитель табачной мозаики, названный впоследствии вирусом. Труды по фитопатологии и физиологии растений.
Гамалея - выдающийся микробиолог. Вместе с И. И. Мечниковым в 1886 году организовал в Одессе первую в России бактериологическую станцию. Автор многих работ по микробиологии и иммунологии (по профилактике холеры, чумы, оспы, паразитарных тифов, бешенства). Открыл бактериолизины, возбудители холеры птиц. Обосновал значение дезинсекции для ликвидации сыпного и возвратного тифов. В 1888 году ученый издал книгу "О прививках против сибирской язвы".
Здровский (1890-1976 года), российский микробиолог, иммунолог и эпидемиолог, академик АМН. Исследования по проблемам тропических болезней, бруцеллеза и др. Под руководством Здродовского разработаны методы вакцинации против столбняка, дифтерии и др. инфекций. Автор книги "Учение о риккетсиях и риккетсиозах"
Смородинцев, российский вирусолог и иммунолог. Труды по этиологии и профилактике гриппа, энцефалитов и др. вирусных инфекций. Совместно с М. П. Чумаковым разработал и внедрил вакцину против полиомиелита.
Ермольева, российский микробиолог. Получила первые отечественные образцы антибиотиков - пенициллина, стрептомицина и др.; интерферона.
Жданов, российский вирусолог. Труды по вирусным инфекциям, молекулярной биологии и классификации вирусов, эволюции инфекционных болезней.
10. ТИПЫ И МЕХАНИЗМЫ ПИТАНИЯ БАКТЕРИЙ
1.По типу питания
По источнику углерода:
а).автотрофы ( использ. Двуокись углерода, карбонаты; не нуждаются в орг. Соединениях)
б). гетеротрофы ( использ органич. Соед. Многоатомные спирты, А.К. органические кислоты и т. д.
По источнику энергии
а) фототрофы ( использ солнечный свет)
б) хемотрофы ( использ. окислительно восстановительные реакции)
Для поглощения питательных веществ из внешней среды микроорганизмы используют:
1) пассивный перенос( простая диффузия, облегченная диффузия)
2) активный транспорт
3) транспорт с транслокацией химических групп
11. ФЕРМЕНТЫ
Ферменты это специфичные, эффективные белковые катализаторы всех химических превращений, происходящих в клетке
Классификация ферментов микроорганизмов
1. по биохимическому действию
оксиредуктазы
гидролазы
изомеразы
трансферазы
лиазы
лигазы
2. по локализации:
а) эндоферменты
б) экзоферменты ( 1. ферменты, осуществляющие « внешнее питание» 2. Ферменты патогенности)
Ферментативный состав является стабильным признаком для каждого вида микроорганизмов , поэтому обнаружение ферментативной активности микроорганизмов применяют при их идентификации
Группы ферментов, которые определяют при идентификации микрооганизмов :
1) сахаролитические( разлагают углеводы, многоатомные спирты)
2) протеолитические ( разлагают белки, аминокислоты)
3) ферменты патогенности
12. Бактерии размножаются путем бинарного деления пополам, реже путем почкования. Актиномицеты, как и грибы, могут размножаться спорами. Актиномицеты, являясь ветвящимися бактериями, размножаются путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные — путем перетяжки, в результате образования гантелевид-ных фигур, из которых образуются две одинаковые клетки.
При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры. Рост периодической культуры бактерий, выращиваемых на жидкой питательной среде, подразделяют на несколько фаз, или периодов:1. лаг-фаза;2. фаза логарифмического роста; 3. фаза стационарного роста, или максимальной концентрациибактерий; 4. фаза гибели бактерий.
Вопрос №13
Методы культивирования анаэробов. Для культивирования анаэробов необходимо понизить окислительно-восстановительный потенциал среды, создать условия анаэробиоза, т. е. пониженного содержания кислорода в среде и окружающем ее пространстве. Это достигается применением физических, химических и биологических методов. -Физические методы. Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается: 1) посевом в среды, содержащие редуцирующие и легко окисляемые вещества; 2) посевом микроорганизмов в глубину плотных питательных сред; 3) механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы; 4) заменой воздуха в сосудах каким-либо индифферентным газом. В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных или растительных тканей (печень, мозг, почки, селезенка, кровь, картофель, вата). Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10—15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла. Высота слоя масла в пробирке около 1 см. Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта — Тароцци, которая используется с успехом для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов. Удаление воздуха производят путем его механического откачивания из специальных приборов — анаэроста-тов, в которые помещают чашки с посевом анаэробов. Переносный анаэростат представляет собой толстостенный металлический цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса. -Химические методы. Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэро-стате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия Na2S204. -Биологические методы. Основаны на совместном выращивании анаэробов со строгими аэробами. Для этого из застывшей агаровой пластинки по диаметру чашки вырезают стерильным скальпелем полоску агара шириной около 1 см. Получается два агаровых полудиска в одной чашке. На одну сторону агаровой пластинки засевают аэроб, например часто используют S. aureus или Serratia marcescens. На другую сторону засевают анаэроб. Края чашки заклеивают пластилином или заливают расплавленным парафином и помещают в термостат. При наличии подходящих условий в чашке начнут размножаться аэробы. После того, как весь кислород в пространстве чашки будет ими использован, начнется рост анаэробов (через 3—4 сут). В целях сокращения воздушного пространства в чашке питательную среду наливают возможно более толстым слоем. -Комбинированные методы. Основаны на сочетании физических, химических и биологических методов создания анаэробиоза.
Культивирование аэробов
Для выращивания аэробов необходимы питательные среды, создание оптимальных температурных условий и наличие кислорода. Обычно рост бактерий в виде помутнения жидких питательных сред или образования колоний на плотных средах наблюдается через 18—24 ч культивирования в термостате. Для того чтобы изучить морфологические, культуральные, ферментативные (биохимические) и другие свойства микробов определенного вида, необходимо получить его чистую культуру. Чистая культура — микроорганизмы одного вида, полученные из одной или нескольких клеток в результате размножения на искусственной питательной среде. Существуют различные методы получения чистой культуры из микробных ассоциаций.
Чистую культуру аэробов получают обычно, засевая каплю исследуемого материала на поверхность застывшего агара в чашке Петри. Каплю распределяют по всей чашке с помощью специального шпателя Дригальского или бактериологической петли. Из отдельных микробных клеток через 16—20 ч культивирования в термостате образуются изолированные колонии. Каждая колония — популяция микроорганизмов, развившаяся из одной бактериальной клетки определенного вида бактерий. Колонии бактерий имеют различные размеры (от 2 до 4 мм), округлую правильную или неправильную форму, гладкую или шероховатую поверхность, ровные или фестончатые края и различную консистенцию. Колонии бактерий могут быть бесцветными или имеют белый, золотистый, красный, лимонно-желтый цвет за счет образования пигмента.
Вопрос № 14
Классификация
По исходным компонентам:
-натуральные среды - готовят из продуктов животного и растительного происхождения(мясо, костная и рыбная мука, кормовые дрожжи, сгустки крови и др.)
-синтетические среды - готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.
-По консистенции( степени плотности): жидкие, полужидкие, плотные
По составу:
-простые: мясопептонный бульон(МПБ), мясопептонный агар(МПА), , питательный желатин,
-сложные - готовят прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества.
По назначению:
-основные - служат для культивирования большинства патогенных микробов. МПБ, МПА, бульон и агар Хоттингера, пептонная вода.
-специальные - служат для выделения и выращивания микроорганизмов, не растущих на простых средах.
-элективные( избирательные) - служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов.Среды становятся элективными при добавлении к ним определённых антибиотиков, солей, изменения pH.Жидкие элективные среды называют средами накопления.
-дифференциально-диагностические - позволяют отличить один вид микробов от другого по ферментативной активности.
-консервирующие - предназначены для первичного посева и транспортировки исследуемого материала.
Вопрос №15
Питательная среда — вещество или смесь веществ, применяемая для культивирования макро- и микроорганизмов. Существует множество стандартных биологических питательных сред.
Требования, предъявляемые к средам
-быть питательными, т.е. содержать в легко усвояемом виде все вещества, необходимые для удовлетворения пищевых и энергетических потребностей. При культивировании ряда микроорганизмов в среды вносят факторы роста- витамины, некоторые аминокислоты, которые клетка не может синтезировать.
-иметь оптимальную концентрацию водородных ионов - pH, т.к. только при оптимальной реакции среды, влияющей на проницаемость оболочки, микроорганизмы могут усваивать питательные вещества.
-быть изотоничными для микробной клетки; т.е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальная среда, соответствующая 0,5% раствору натрия хлорида.
-быть стерильными, т.к. посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды.
-плотные среды́ должны быть влажными и иметь оптимальную для микроорганизмов консистенцию.
-обладать определённым окислительно - восстановительным потенциалом, т.е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH2. Например, анаэробы размножаются при RH2, не выше 5, а аэробы - при RH2 не ниже 10.
-быть по возможности унифицированным, т.е. содержать постоянное количество отдельных ингредиентов.
-Желательно, чтобы среды́ были прозрачными - удобнее следить за ростом культур, легче заметить загрязнение среды посторонними микроорганизмами.
19. Бактериофа́ги (фаги) (от др.-греч. φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Размер частиц приблизительно от 20 до 200 нм.
Строение бактериофагов
Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток.
Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2 — 4 раза больше диаметра головки. В головке содержится генетический материал — одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окруженная белковой или липопротеиновой оболочкой — капсидом, сохраняющим геном вне клетки.
Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные. Хвост представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные[11].
Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они переносят всю информацию для запуска собственной репродукции в соответствующем хозяине, у них отсутствуют механизмы для выработки энергии и рибосомы для синтеза белка. У некоторых фагов в геноме содержится несколько тысяч оснований, тогда как фаг G, самый крупный из секвенированных фагов, содержит 480 000 пар оснований — вдвое больше среднего значения для бактерий, хотя всё же недостаточного количества генов для важнейшего бактериального органоида как рибосомы.
Взаимодействие бактериофага с бактериальными клетками
По характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги. Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла. Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки.
Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остается снаружи. Инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние (ДНК-полимеразы, нуклеазы) и поздние (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза) белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц.
Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги[11]. Иногда фаг инициирует лизирующий цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определенных условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фага оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют лизирующей реакции.
Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определенного вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый цикл.
Адсорбция бактериофага на фагоспецифических рецепторах клетки.
Инъекция фаговой нуклеиновой кислоты в клетку хозяина.
Совместная репликация фаговой и бактериальной нуклеиновой кислоты.
Деление клетки.
Далее бактериофаг может развиваться по двум моделям: лизогенный либо литический путь.
Умеренные лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков.
Вирулентные проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Процесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и весьма схож с процессом взаимодействия вирусов человека и животных с клеткой хозяина. Нуклеиновая кислота фага направляет синтез ферментов фага, используя для этого белоксинтезирующий аппарат бактерии. Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага «подчиняет» себе клеточный аппарат синтеза белка.
Нуклеиновая кислота фага реплицируется, и направляет синтез новых белков оболочки. Образуются новые частицы фага в результате спонтанной самосборки белковой оболочки (капсид) вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200—1000 новых фагов; фаги инфицируют другие бактерии.
Лизогения- генетически обусловленная способность бактерий лизироваться с выделением бактериофага через ряд поколений после непосредственного заражения им. (Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом)).Теория Л. разработана в 1950 французскими учёными А. Львовым и А. Гутман, показавшими, что лизогенное состояние связано с присутствием в клетках бактерий потенциально инфекционной структуры — Профага. В каждом поколении лизогенных бактерий подвергается Лизису очень небольшая часть клеток (Лизогения1 клетка на миллион) с освобождением от 70 до 150 частиц так называемого умеренного фага. Частота перехода профага в инфекционное состояние (индукция профага) может быть увеличена рядом агентов (например, ультрафиолетовыми лучами). После заражения бактериальной клетки умеренным фагом процесс инфекции может развиваться по одному из двух направлений (см. рис.): по пути литического цикла, который так же, как и при заражении бактерий вирулентными фагами, заканчивается лизисом клеток и выходом потомства фага в окружающую среду; по пути лизогенизации, когда в результате биосинтетических процессов в клетке вырабатывается иммунитет к инфицирующему фагу, фаговая ДНК включается в ДНК бактерии и в дальнейшем реплицируется вместе с ней как её составная часть (профаг), а бактерия выживает и становится лизогенной. Судьба клетки решается на первых этапах инфекции и зависит главным образом от времени формирования иммунитета. Если состояние иммунитета наступает раньше, чем развитие инфекции достигнет стадии, необратимо ведущей к лизису, то может осуществиться лизогенизация. В Геноме бактерий могут содержаться одновременно профаги нескольких разных фагов (пол и лизогения). В этом случае клетка обладает иммунитетом в отношении всех этих фагов. В результате лизогенизации может произойти изменение некоторых свойств бактериальной клетки (т. н. Лизогенная конверсия), обусловленное приобретением бактерией новой генетической информации. Искусственно полученные лизогенные бактерии по своим свойствам не отличаются от лизогенных бактерий, найденных в естественных условиях. У небольшой части потомства лизогенной клетки происходит «исцеление» — потеря профага. Утратившие профаг клетки дают начало нелизогенным линиям. Частота этого процесса может быть увеличена, например, действием ультрафиолетовых лучей. Т. о., Л. — сложная форма вирусной инфекции у бактерий, при которой от момента заражения бактерий фагом до лизиса клетки проходит большое число клеточных поколений.
20. В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.
Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молеклул ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 т.п.н. Причем, фаги без вставок — менее 38 т.п.н или, напротив, со слишком большими вставками — более 52 т.п.н не развиваются и не поражают бактерии
В биологии
Бактериофаги M13, фаг Т4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Поскольку размножение бактериофага возможно только в живых клетках бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия фаг-микробная клетка.
21. ВЫРАЩИВАНИЕ ВИРУСОВ В КУЛЬТУРАХ КЛЕТОК.
В настоящее время для выделения и размножения вирусов животных используются первичные культуры, штаммы клеток и установившиеся клеточные линии. В общих чертах процедура оказывается одинаковой для всех вирусов.
Среду удаляют с клеточного монослоя и монослой промывают сбалансированными буферными солевыми растворами (СБСР) или фосфатно-солевым буфером (ФСБ) для удаления ингибиторов (антител), которые могут присутствовать в среде. Вирусные частицы суспендируются в небольшом количестве СБСР или ФСБ и адсорбируются клетками в течение 30 - 60 мин. После этого солевые растворы заменяются свежей средой.
Заражение вирусами культивируемых клеток вызывает характерные морфологические изменения клеток. Конечные дегенеративные клеточные процессы (цитопатогенный эффект, ЦПЭ) обнаруживаются только через несколько недель роста в присутствии вирусов, но в ряде случаев ЦПЭ обнаруживаются уже через 12 ч. Детали морфологических изменений оказываются различными в случае разных вирусов. Если вместо продуктивной инфекции вирус вызывает клеточную трансформацию, то это также сопровождается характерными изменениями морфологии и особенностей роста клеток.
22. Изменчивость бактерий
Микробы обладают большой приспособляемостью к внешним условиям и изменчивостью, которая выражается непостоянством формы, величины, культуральных, ферментативных реакций, а также биологических свойств. Изменчивость может проявиться в виде адаптации, мутации и диссоциации.
Адаптация- - самая распространенная форма изменчивости. Возникает она вследствие длительного при-способления организмов к различным условиям внешней среды
Мутация - - форма наследственной изменчивости организмов. Она характеризуется внезапным: появлением не свойственных данному виду микробов новых свойств.
Диссоциация микробов – разделение однородной популяции на 2 типа колоний. Делятся на S- и R- колонии. Пользуясь явлением диссоциации, можно получить расы бактерий, необходимые для приготовления безвредных и эффективных вакцин.
Генотип – набор генов бакт-й клетки,Сов-ть генов,определяющих его потенц-ю способность к фенотипическому выражению запис в них инф-ии в виде опр признаков. Мат-я основа – ДНК. Т.же ген-й матер-л сод-ся во внехромосомных ф-рах наследственности
Фенотип бактерий — комплекс признаков, которые проявляются у бактерии в конкретных условиях ее существования. Представляет собой результат взаимодействия ее генотипа и среды, т. е. эти признаки проявляются фенотипически лишь в определенных условиях внешней среды и не наследуются. Например, некоторые виды бактерий обладают способностью синтезировать, ферменты, расщепляющие лактозу. Этот признак обусловлен определенным элементарным участком хромосомы бактерии (ДНК). При определенных условиях среды происходит мутирование (превращение его), в результате чего изменяются признаки, указанные выше, и такая бактерия не синтезирует соответствующие полноценные ферменты независимо от наличия углевода в среде. Взаимодействие между этими генотипами и соответствующими фенотипами в зависимости от условий окружающей среды показано на схеме.
23.Виды генетической рекомбинации у бактерий.
Генетические рекомбинации Бактерии способны обмениваться генетическим материалом и, по аналогии с половым размножением, давать начало потомству с новыми свойствами. При этом образуется ДНК, которая содержит гены обеих родительских клеток. Такую ДНК называют рекомбинантной. У потомства, или рекомбинантов, наблюдается заметное разнообразие признаков, вызванное смешением генов. Известны три способа получения рекомбинантов: путем трансформации, трансдукции и конъюгации.
Трансформация — процесс поглощения клеткой организма свободной молекулы ДНК из среды и встраивания её в геном, что приводит к появлению у такой клетки новых для неё наследуемых признаков, характерных для организма-донора ДНК.
Трансдукция (от лат. transductio — перемещение) — процесс переноса бактериальной ДНК из одной клетки в другую бактериофагом.
Конъюга́ция (от лат. conjugatio — соединение), парасексуальный процесс — однонаправленный перенос части генетического материала (плазмид, бактериальной хромосомы) при непосредственном контакте двух бактериальных клеток.
24. Плазмиды бактерий и их значение
Плазмиды-внехромосомные факторы наследственности,не являются генетическими элементами жизненно важными для клетки т.к. не несутинф-и о синтезе ферм-в. Но могут давать бактериям опр-е селектив. преимущ-ва,н-р:резистентность к АБ. П.- либо не св-ны с хромосомой либо встроены в ее состав. В автономном сост. самост. реплицируются .
Вып-т РЕГУЛЯТОРНУЮ и КОДИРУЮЩУЮ ф-ю. Рег-я ф-я: компенсац нарушений метаболизма ДНК кл-ки хозяина.
Кодирующ. : внесение в бак-ю кл-ку новой инф-ии,о кот-й судят по приобр. признаку , н-р: образование пилей. Бывают: F- плазмиды или половой ф-р; R-плазмиды – опр-т устойч м\о к ЛП; Плазмиды патогенности – контролируют вирулентные св-ва бакт. и токсинообразование.
43) Классификация антибиотиков
С учетом механизма действия антибиотики разделяют на три основные группы:
ингибиторы синтеза клеточной стенки микроорганизма (пенициллины, цефалоспорины, ванкомицин, тейкопланин и др.);
антибиотики, нарушающие молекулярную организацию, функции клеточных мембран (полимиксин, нистатин, леворин, амфотерицин и др.);
антибиотики, подавляющие синтез белка и нуклеиновых кислот, в частности, ингибиторы синтеза белка на уровне рибосом (хлорамфеникол, тетрациклины, макролиды, линкомицин, аминогликозиды) и ингибиторы РНК-полимеразы (рифампицин) и др.
По химическому строению выделяют следующие группы антибиотиков: бета-лактамы (пенициллины, цефалоспорины и др.); аминогликозиды; хлорамфеникол, тетрациклины; фузидин; ансамакролиды (рифампицины), полимиксины, полиены; макролиды и др.
В зависимости от типа воздействия на микробную клетку антибиотики классифицируют на две группы:
бактерицидные (пенициллины, цефалоспорины, аминогликозиды, рифампицин, полимиксины и др.);
бактериостатические (макролиды, тетрациклины, линкомицин, хлорамфеникол и др.).
Для инфекциониста-клинициста особенно важно знать спектр противомикробного действия антибиотиков, так как с его учетом определяется выбор антибиотика.
По спектру противомикробного действия антибиотики разделяют на следующиие группы:
1) Препараты, действующие преимущественно на грамположительные и грамотрицательные кокки (стафилококки, стрептококки, менингококки, гонококки), некоторые грамположительные микробы (коринебактерии, клостридии). К этим препаратам относятся бензилпенициллин, бициллины, феноксиметилпенициллин, пенициллиназоустойчивые пенициллины (оксациллин, метициллин), цефалоспорины 1-го поколения, макролиды, ванкомицин, линкомицин.
2) Антибиотики широкого спектра действия, активные в отношении грамположительных и грамотрицательных палочек: хлорамфеникол, тетрациклины, аминогликозиды, полусинтетические пенициллины широкого спектра действия (ампициллин, азлоциллин и др.) и цефалоспорины 2-го поколения.
3) Антибиотики с преимущественной активностью в отношении грамотрицательных палочек (полимиксины, цефалоспорины 3-го поколения).
4) Противотуберкулезные антибиотики (стрептомицин, рифампицин, флоримицин).
5) Противогрибковые антибиотики (нистатин, леворин, гризеофульвин, амфотерицин В, кетоконазол, анкотил, дифлюкан и др.).
Вышеперечисленные свойства в основном и диктуют выбор антибиотика для лечения инфекционного больного. При этом обязательно учитываются фармакодинамика и фармакокинетика препарата, индивидуальные особенности больного (возраст, состояние иммунитета, сопутствующие заболевания и др.).
Эффективность лечения антибиотиками при современном их назначении во многом определяется следующими факторами:
этиологической диагностикой заболевания, клинической диагностикой нозологических форм инфекционного заболевания, выделением возбудителя болезни с последующим определением его чувствительности к антибиотикам;
выбором наиболее активного и в то же время наименее токсичного для конкретного больного препарата;
определением оптимальной дозы антибиотика, метода его введения для создания концентрации в очаге инфекции, в 2-3 раза превышающей минимальную подавляющую концентрацию (МПК) для данного микроба;
знанием и учетом возможных побочных реакций на антибиотик;
применением по соответствующим показаниям комбинации препаратов с целью расширения спектра их действия и/или усиления противомикробного эффекта.
44) Различают три возможных способа получения антибиотиков: био-синтез; химическая или биотехнологическая модификация природных антибиотиков и химический синтез. Большинство антибиотиков обладает сложной химической структурой, поэтому их полный химический синтез очень трудоёмок и экономически невыгоден.
Исключение составляют хлорамфеникол и некоторые другие вещества, имеющие относительно простое химическое строение. Основным путём получения большинства антибиотиков является биотехнологический способ. Антибиотики продуцируются плесневыми грибами, актиномицетами, эубактериями и другими микроорганизмами. Один и тот же вид микроорганизмов может синтезировать несколько антибиотиков. Например, Streptomyces griseus синтезирует более 50 антибиотиков.
Существует несколько вариантов биотехнологического получения природных и полу синтетических антибиотиков:
1. Прямая ферментация микроорганизма-продуцента с веществом, являющимся метаболическим предшественником получаемого антибиотика и стимулирующим процесс его биосинтеза. Например, биосинтез бензилпенициллина ведут в присутствии фенилук- сусной кислоты, макролидов – в присутствии пропионовой кислоты и пропилового спирта.
2. Использование для биосинтеза антибиотиков микроорга- низмов-мутантов, у которых блокированы определённые ферменты, участвующие в синтезе антибиотика. Если в среду, содержащую такой микроорганизм ввести аналог предшественника антибиотика, то при этом можно получить модифицированный антибиотик.
Мутационный биосинтез используется, например, для получения полусинтетиче- скихпенициллинов и цефалоспоринов. Большинство антибиотиков получают при глубинной аэробной ферментации периодического действия в асептических условиях.
45) Токсическое действие препаратов - развитие этого осложнения зависит от свойств самого препарата, его дозы, способа введения, состояния больного и проявляется только при длительном и систематическом применении антимикробных химиотерапевтических препаратов, когда создаются условия для их накопления в организме.
Предупреждение осложнений состоит в отказе от противопоказанных данному пациенту препаратов, контроле за состоянием функций печени, почек и т. п.
Дисбиоз (дисбактериоз). Антимикробные химиопрепараты, особенно широкого спектра, могут воздействовать не только на возбудителей инфекций, но и на чувствительные микроорганизмы нормальной микрофлоры. В результате формируется дисбиоз, поэтому нарушаются функции ЖКТ, Предупреждениепоследствий такого рода осложнений состоит в назначении, по возможности, препаратов узкого спектра действия, сочетании лечения основного заболевания с противогрибковой терапией витаминотерапей, применением эубиотиков и т. п.
Отрицательное воздействие на иммунную систему - аллергические реакции. Причинами развития гиперчувствительности может быть сам препарат, продукты его распада, а также комплекс препарата с сывороточными белками. Предупреждение осложнений состоит в тщательном сборе аллергоанамнеза и назначении препаратов в соответствии с индивидуальной чувствительностью пациента. Кроме того, антибиотики обладают некоторым иммунодепрессивным действием и могут способствовать развитию вторичного иммунодефицита и ослаблению напряженности иммунитета.
Эндотоксический шок (терапевтический). Это явление, которое возникает при лечении инфекций, вызванных грамотрицательными бактериями. Введение антибиотиков вызывает гибель и разрушение клеток и высвобождение больших количеств эндотоксина.
Взаимодействие с другими препаратами. Антибиотики могут способствовать потенцированию действия или инактивации других препаратов (например, эритромицин стимулирует выработку ферментов печени, которые начинают ускоренно метаболизировать лекарственные средства разного назначения).
Побочное воздействие на микроорганизмы.
Применение антимикробных химиопрепаратов оказывает на микробы не только прямое угнетающее или губительное воздействие, но также может привести к формированию атипичных форм
Профилактика развития осложнений состоит прежде всего в соблюдении принципов рациональной антибиотикотерапии
• Микробиологический принцип. До назначения препарата следует установить возбудителя инфекции и определить его индивидуальную чувствительность к антимикробным химиотерапевтическим препаратам. По результатам антибиотикограммы больному назначают препарат узкого спектра действия, Если возбудитель неизвестен, то обычно назначают препараты более широкого спектра, активные в отношении всех возможных микробов, наиболее часто вызывающих данную патологию.
• Фармакологический принцип. Учитывают особенности препарата — его фармакокинетику и фармакодинамику, распределение в организме, кратность введения, возможность сочетания препаратов. Дозы препаратов продолжительность лечения,
• Клинический принцип. При назначении препарата учитывают, насколько безопасным он будет для данного пациента, что зависит от индивидуальных особенностей состояния больного
•Эпидемиологический принцип. Выбор препарата, особенно для стационарного больного, должен учитывать состояние резистентности микробных штаммов, циркулирующих в данном отделении, стационаре и даже регионе.
• Фармацевтический принцип. Необходимо учитывать срок годности и соблюдать правила хранения препарата, так как при нарушении этих правил антибиотик может не только потерять свою активность, но и стать токсичным за счет деградации. Немаловажна также и стоимость препарата.
52. Имму́нная систе́ма — подсистема, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознает множество разнообразных возбудителей: от вирусов до паразитических червей - и отличает их от биомолекулсобственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
В иммунной системе развитых организмов существует множество способов обнаружения и удаления чужеродных агентов, этот процесс называется иммунным ответом. Все формы иммунного ответа можно разделить на приобретённые и врождённые реакции. Основное различие между ними в том, что приобретённый иммунитет высокоспецифичен по отношению к конкретному типу антигенов и позволяет быстрее и эффективнее уничтожать их при повторном столкновении.Антигенами называют вызывающие специфические реакции организма молекулы, воспринимаемые как чужеродные агенты. Например, у перенёсших ветрянку, корь, дифтерию людей часто возникает пожизненный иммунитет к этим заболеваниям. В случае аутоиммунных реакций антигеном может служить молекула, произведенная самим организмом.
53. Иммунокомпетентные клетки, кооперация клеток в иммунном ответе
Иммунокомпетентные клетки (ИКК)
Лимфоциты
-Основная функция-высокоспецифичное распознавание чужеродных и измененных собственных АГ.
-имеют одинаковую морфологию, но различные рецепторы и функции;
-происходят из единой стволовой клетки.
П опуляции
лимфоцитов
опуляции
лимфоцитов
Т-Ly
(СД2 СД3) В-Ly
Созревают в тимусе (СД19,СД20,СД21)
Созревают в костном мозге
Субпопуляции т- Лимфоцитов
-Т-хелперы (СД4)-стимулируют клетки иммунной системы
А Г-Тх(0)
Тх1 Тх2(гуморальный иммунный ответ)
( клеточный
иммунный ответ)
Образование Т х1 стимулируют антигены внутриклеточных паразитов(микобактерии, листерии)
Образование Т х2 стимулируют аллергены, антигены гельминтов.
-Т-эффекторы (СД4+)-опосредуют реакции ГЗТ
-Т-супрессоры- регулируют интенсивность иммунного ответа, подавляя активность СД4+ клеток;
-предотвращают развитие аутоиммунных реакций;
-обеспечивают толерантность матери к чужеродным антигенам плода.
-Цитотоксические лимфоциты (ЦТЛ) или Т-киллеры (СД8+)
-лизируют клетки- мишени, несущих чужеродных или видоизмененных аутоантигены (клетки опухолей трансплантантов, клетки, инфизированные вирусами)
Цитотоксический эффект Т-киллеров реализуют через образование в клетках –мишенях под действием белков-перфоринов.
-Т-клетки памяти-образуют при первичном иммунном ответе. Специфических распознают антиген и участвуют в формировании вторичного иммунного ответа.
В-лимфоциты
Основной маркер –мембранный lg
А Г В-Ly
Плазматические клетки В-клетки памяти
(продуценты АТ)
54. Антигены. Свойства. Антигенная структура бактериальной клетки. А нтигенны
Т-зависимые Т-независимые
Антигены, которым для антигены ,которые могут вы-
начала образования антител В-клетками зывать выработку антител требуется участие Т-ЛФ (белки и полипептиды) В-ЛФ без участия Т-ЛФ (белки, полисахариды ЛПС и др)
бактерии-содержат Т-зависимые и Т-независимые антигены
вирусы-содержат только Т-зависимые антигены
Методы определения антигенов гистосовместимости:
-реакция иммунофлюоресценции
-радиоактивное маркирование
-HLA-типирование в реакции комплементзависимого лимфоцитолиза
-реакция на основе розеткообразующих эритроцитов, нагруженных стафилокковым белком А
-РБТЛ
Антигены микроорганизмов:
Группоспецифических-есть у разных видов одного и того же рода или семейства.
Видоспецифические- есть у разных представителей одного вида.
Типоспецифические-есть у разных вариантов в пределах одного и того же вида. На их основе микробы в пределах одного вида делят на серовары.
Антигенная структура бактерий:
Н-антиген-жгутиковый- белок, термолабилен, обезвреживается фенолом
О-антиген-соматический-связан с клеточной стенкой, полисахарид, термостабилен, не обезвреживается формалином.
К-антиген-капсульный-связан с клеточной стенкой и капсулой, полисахарид. А –АГ-термостабильный, L-АГ-термолабильны, В-АГ-Vi антиген верулентности.
55. Иммуноглобулины, структура, свойства. Классы иммуноглобулинов, их характеристика.
1. Структура иммуноглобулинов
Антитела (иммуноглобулины) – это белки, которые синтезируются под влиянием антигена и специфически с ним реагируют.
Они состоят из полипептидных цепей. В молекуле иммуноглобулина различают четыре структуры:
1) первичную – это последовательность определенных аминокислот. Она строится из нуклеотидных триплетов, генетически детерминируется и определяет основные последующие структурные особенности;
2) вторичную (определяется конформацией полипептидных цепей);
3) третичную (определяет характер расположения отдельных участков цепи, создающих пространственную картину);
4) четвертичную. Из четырех полипептидных цепей возникает биологически активный комплекс. Цепи попарно имеют одинаковую структуру.
Большинство молекул иммуноглобулинов составлено из двух тяжелых (H) цепей и двух легких (L) цепей, соединенных дисульфидными связями. Легкие цепи состоят или из двух k-цепей, или из двух l-цепей. Тяжелые цепи могут быть одного из пяти классов (IgA, IgG, IgM, IgD и IgE).
Каждая цепь имеет два участка:
1) постоянный. Остается постоянным в последовательности аминокислот и антигенности в пределах данного класса иммуноглобулинов;
2) вариабельный. Характеризуется большой непостоянностью последовательности аминокислот; в этой части цепи происходит реакция соединения с антигеном.
Каждая молекула IgG состоит из двух соединенных цепей, концы которых формируют два антигенсвязывающих участка. На вариабельном участке каждой цепи имеются гипервариабельные участки: три в легких цепях и четыре в тяжелых. Разновидности последовательности аминокислот в этих гипервариабельных участках определяют специфичность антитела. При определенных условиях эти гипервариабельные области могут также выступать в роли антигенов (идиотипов).
В молекуле иммуноглобулина меньше двух антигенсвязывающих центров быть не может, но один может быть завернут внутрь молекулы – это неполное антитело. Оно блокирует антиген, и тот не может связаться с полными антителами.
При энзиматическом расщеплении иммуноглобулинов образуются следующие фрагменты:
1) Fc-фрагмент содержит участки обеих постоянных частей; не обладает свойством антитела, но имеет сродство с комплементом;
2) Fab-фрагмент содержит легкую и часть тяжелой цепи с одним антигенсвязывающим участком; обладает свойством антитела;
3) F(ab)Т2-фрагмент состоит из двух связанных между собой Fab-фрагментов.
Другие классы иммуноглобулинов имеют такую же основную структуру. Исключение – IgM: является пентамером (состоит из пяти основных единиц, связанных в области Fc-концов), а IgA – димер.
2. Классы иммуноглобулинов и их свойства
Существует пять классов иммуноглобулинов у человека.
1. Иммуноглобулины G – это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент.
Свойства иммуноглобулинов G:
1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях;
2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных;
3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации.
2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2.
Свойства иммуноглобулинов М:
1) не проникают через плаценту;
2) появляются у плода и участвуют в антиинфекционной защите;
3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент;
4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза;
5) образуются на ранних сроках инфекционного процесса;
6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий.
3. Иммуноглобулины А – это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов.
Свойства иммуноглобулинов А:
1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче;
2) участвуют в местном иммунитете;
3) препятствуют прикреплению бактерий к слизистой;
4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
4. Иммуноглобулины Е – это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов.
Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа.
5. Иммуноглобулины D – это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани.
Свойства иммуноглобулинов D:
1) участвуют в развитии местного иммунитета;
2) обладают антивирусной активностью;
3) активируют комплемент (в редких случаях);
4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа;
5) участвуют в аутоиммунных процессах.
Ig M
К этому классу относится примерно 10% общего пула иммуноглобулинов сыворотки.
Из всех иммуноглобулинов IgM организован наиболее сложно и имеет наибольший мол. вес - 970 кД. Он состоит из пяти мономеров, каждый из которых включает две тяжелые цепи ( мю-цепи ) и две легкие цепи ( каппа-цепи или лямбда-цепи ). Мономеры объединены в единую пентамерную молекулу дисульфидными связями (-S-S-) и J-цепью . Пять мономерных субъединиц расположены радиально. При этом Fc-фрагменты направлены в центр круга, а Fab-фрагменты - наружу ( рис. 2.14 ).
В состав мю-цепи входит четыре C-домена : Cмю1 , Cмю2 , Cмю3 и Cмю4 ), но при этом в структуре тяжелой цепи отсутствует шарнирный участок .
В какой-то степени его функцию выполняет Смю2 -домен, имеющий остатки пролина. Предполагается, что именно этот домен явился эволюционным предшественником шарнирной области гамма-цепи иммуноглобулина IgG и альфа-цепи иммуноглобулина IgA . Реконструкция IgM по данным рентгеноструктурного анализа ( рис. 2.14 ) демонстрирует гибкость Fab -фрагмента за счет остатков пролина Смю2, что позволяет "находить" соответствующие антигенные детерминанты на поверхности антигенпрепрезентирущей клетки .
Предпоследний остаток цистеина в хвостовом С-концевом отрезке, содержащем 18 аминокислотных остатков, очевидно, необходим для полимеризации мономеров в пентамер с помощью J-цепи (англ. joining - присоединение). J-цепь представляет собой полипептид из 137 аминокислотных остатков, образующих домен иммуноглобулинового типа. Каждая молекула IgM содержит только одну J-цепь.
Каждая мю-цепь имеет по пять олигосахаридов: один - в Смю1, три - в Смю3 и один - в хвостовой части.
Помимо пентамерной свободной формы IgM имеется мономерная форма этого иммуноглобулина, которая представлена на поверхности В-клеток и выполняет функцию антигенраспознающего рецептора . Отличие мономера, ассоциированного с мембраной, от пентамера состоит в количестве аминокислотных остатков в хвостовой части тяжелой цепи . Тяжелая цепь мономера включает 41 аминокислотный остаток в хвостовой части. Из них 25 гидрофобных аминокислотных остатков принадлежит трансмембранному отрезку.
Подклассов IgM человека пока не обнаружено.
В процессе гуморального иммунного ответа наиболее ранние антитела относятся к IgM-классу. Они же первыми появляются в онто- и филогенезе и содержатся преимущественно во внутрисосудистом пуле иммуноглобулинов. Наибольшую активность IgM проявляет в антибактериальном иммунитете и при некоторых аутоиммунных заболеваниях .
(Дополнительная информация об IgM и генетическом контроле структуры этого иммуноглобулина представлена в дальнейшем в главах: " Антигенраспознающие рецепторы B-клеток " и " IgM: генетический контроль синтеза структуры ").
IgM (m класс тяжелых цепей) обнаруживается преимущественно внутри сосудов .
Молекула IgM представляет собой пентамер - полимер из пяти субъединиц, каждая из которых состоит из четырех полипептидных цепей и имеет дополнительный CH -домен. IgM часто называют макроглобулином из-за высокой мол. массы. Как и в случае IgA, полимеризация субъединиц происходит за счет J-цепи . В ее функции, вероятно, входит стабилизация сульфгидрильных групп Fc -фрагмента в процессе синтеза Ig, благодаря чему они сохраняют способность образовывать перекрестные связи между субъединицами и формируют сложную структуру.
Изогемагглютинины (анти-A, анти-B) и многие из "нормальных" антител к микроорганизмам, как правило, относятся к иммуноглобулинам класса M; антитела к тифозному O-антигену ( эндотоксин ), и "WR"-антитела при сифилисе чаще всего тоже принадлежат к этому классу. Очевидно, в филогенезе иммунного ответа позвоночных IgM появились раньше IgG .
Если рецептором B-лимфоцитов , узнающим антиген, является IgM, то IgM, как правило, представляет собой мономерный иммуноглобулин, т.е. отдельную единицу из четырех полипептидных цепей. Эта молекула имеет гидрофобную последовательность, расположенную в C-концевом участке тяжелой цепи и предназначенную для фиксации молекулы на клеточной мембране.
Ig G
Среди всех классов иммуноглобулинов в количественном отношении доминирует иммуноглобулин G , поэтому он является главным изотипом сыворотки человека. На его долю приходится около 75% от общего количества сывороточных иммуноглобулинов. Молекула иммуноглобулина G ( гамма класс тяжелых цепей) состоит из одной субъединицы приблизительно 150 кД. У человека и мыши описаны по четыре подкласса IgG, которые впервые были обнаружены серологическими методами.
Шарнирная область характеризуется значительным числом остатков пролина и цистеина, что и определяет ее гибкость. Количество дисульфидных связей этой части молекулы варьирует от одного подкласса к другому. Так, в гамма1- и гамма4-цепях таких связей две, в гамма2-цепях - четыре, а в гамма3-цепях - одиннадцать (-S-S- связи обеспечивают взаимодействие двух тяжелых цепей). В гамма1-цепи шарнирная область начинается с 216-го остатка и заканчивается 231-ым. В то же время шарнирная область гамма3-цепи на 47 остатков больше по сравнению с гамма1. Изучение аминокислотной последовательности позволяет предположить, что это увеличение остатков связано с тандемной дупликацией участка 216-231 гамма1-цепи. Существенной особенностью шарнирной области является возникающая в результате взаимодействия двух тяжелых цепей жесткая, циклическая октапептидная структура:
-Cys-Pro-Pro-Cys-
I
I
-Cys-Pro-Pro-Cys-
Она служит осью вращения всей гибкой шарнирной области, а, следовательно, и Fab-фрагментов , что необходимо, вероятно, для взаимодействия с антигеном .
Гомология между гамма-цепями мыши, относящимися, как и у человека, к четырем подклассам, меньше и составляет 60-70%.
Иммуноглобулины класса G равномерно распределены между внутри- и внесосудистыми пулами и составляют большинство антител вторичного иммунного ответа.
Биологическая роль IgG разнообразна. Это и антибактериальная защита через механизм комплемент-зависимого лизиса микробной клетки, и проникновение через плаценту с той же защитной для развивающегося зародыша функцией, и "армирование" макрофагов (цитофильность к макрофагам), в результате чего они становятся цитотоксическими для трансплантатов и опухолей , и участие в повышенной реактивности аллергического типа .
IgG вырабатываются как при первичном , так и при вторичном иммунном ответе . IgG обладают максимальной способностью проникать в ткани, поэтому они наиболее эффективно связывают и удаляют антигены.
IgG - наиболее распространенный иммуноглобулин, обеспечивающий защиту от микроорганизмов и токсинов. Вероятно, при вторичном иммунном ответе синтезируется, в основном, IgG. Поскольку IgG способен преодолевать плацентарный барьер, ему принадлежит главная роль в защите от инфекций в течение нескольких первых недель жизни. У новорожденных защищенность усиливается благодаря поступлению в кровоток содержащегося в молозиве IgG через слизистую кишечника. IgG с большей легкостью, чем иммуноглобулины других классов, распространяется в тканевой жидкости, где доминирует среди антител других изотипов и имеет наибольшее значение для нейтрализации бактериальных токсинов и связывания микроорганизмов с целью их опсонизации . IgG, образуя комплексы с бактериями, активирует комплемент и вызывает хемотаксис полиморфноядерных лейкоцитов . Бактерии, нагруженные антителами и комплементом, прилипают к лейкоцитам , благодаря наличию у последних рецепторов для комплемента и Fc -участков. Аналогично внеклеточное уничтожение клеток-мишений, нагруженных IgG, в основном обусловлено узнаванием поверхностных Fc-гамма нормальными киллерами , обладающими соответствующими рецепторами. Взаимодействие между Fc-рецепторами тромбоцитов и IgG в составе комплексов, возможно, приводит к агрегации и высвобождению вазоактивных аминов, однако физиологическое значение рецепторов для Fc-гамма, расположенных на других типах клеток, в особенности на лимфоцитах , до сих пор не установлено. IgG не способен прочно связываться с тучными клетками кожи человека, но тем не менее это единственный среди всех классов человеческих иммуноглобулинов, который обладает способностью связываться с антигенами в коже морской свинки. В пользу предположения о том, что биологическая индивидуальность различных классов иммуноглобулинов обусловлена константными областями тяжелых цепей, особенно Fc -участками, свидетельствуют описанные выше свойства иммуноглобулинов, а именно, преодоление плацентарного барьера, фиксация комплемента, связывание с различными типами клеток, которые, очевидно, опосредованы Fc-участками молекулы Ig.
Что касается общей регуляции уровня IgG в организме, то можно сказать, что степень катаболизма, вероятно, находится в прямой зависимости от тотальной концентрации IgG, в то время как его синтез в основном регулируется антигенной стимуляцией. К примеру, у животных, содержащихся в стерильных условиях, уровень IgG чрезвычайно низок, но он быстро повышается после помещения животного в нормальные условия.
Большинство подклассов ( IgG1 , IgG2 , IgG3 ) способны связываться с компонентом С1 системы комплемента в области С(H)2-домена и, таким образом, активировать комплемент по классическому пути.
Антигенный анализ миеломных IgG выявил дополнительные вариации и позволил выделить четыре изотипических подкласса, кодируемых цифрами и обозначаемых как IgG1 , IgG2 , IgG3 и IgG4 . Подклассы IgG различаются по способности связывать комплемент и активировать его по альтернативному пути , связываться с рецептором к Fc-фрагменту IgG на разных типах клеток и проникать через плаценту .Структурно ни различаются между собой тяжелыми цепями, а именно гамма1, гамма2, гамма3 и гамма4, соответственно (см. Классы иммуноглобулинов ). Тяжелые цепи IgG обладают значительно выраженной гомологией и имеют одинаковые участки, реагирующие со специфической антиглобулиновой сывороткой. Однако каждый тип тяжелых цепей обладает одной или несколькими дополнительными структурными особенностями, а именно, уникальными первичными последовательностями аминокислот и расположением межцепочечных дисульфидных связей. Это служит причиной различных свойств IgG, относящихся к разным подклассам.
IgA
Иммуноглобулин A содержится преимущественно в выделениях слизистых оболочек - в слюне, слезной жидкости, носовых выделениях, поте, молозиве и в секретах легких , мочеполовых путей и желудочно-кишечного тракта , где обеспечивает защиту поверхностей, сообщающихся с внешней средой, от микроорганизмов. В сыворотке крови его содержание незначительно и составляет всего 10-15% от общего количества всех иммуноглобулинов. См:
IgA аномальный
Мономерная форма IgA построена по классическому типу и составляет более 80% от общего количества этого иммуноглобулина в сыворотке человека. Тяжелая цепь включает V-область , три домена C-области и шарнирный участок .
У человека известно два подкласса секреторного иммуноглобулина ( sIgA ): IgA1 и IgA2 . Соответствующее обозначение тяжелых цепей: альфа1 и альфа2 . Без учета шарнирного участка степень гомологии между альфа1 и альфа2 очень высока и составляет около 95%. Кроме того, подкласс IgA2 имеет два аллельных варианта - аллотипы IgA2m(1) и IgA2m(2) .
За исключением шарнирного участка различия между подклассами IgA1 и IgA2 касаются 14 положений аминокислотных остатков в С-областях тяжелых цепей. При этом различия между аллотипами IgA2m(1) и IgA2m(2) в этих положениях отсутствуют, но они представлены в других участках тяжелых цепей, вблизи шарнирного участка. Именно эти положения определяют серологически выявляемые различия между аллотипами .
Шарнирные области альфа1- и альфа2-цепей значительно отличаются друг от друга. Альфа1-цепь имеет в этом месте на 13 аминокислотных остатков больше, чем альфа2-цепь. При этом последовательности 224-239 альфа1-цепи возникли в результате тандемной дубликации в той части генома, которая контролирует всего восемь аминокислотных остатков ( рис. 2.15 ). Дупликация столь незначительного отрезка ДНК - явление крайне редкое.
Однако особенность этого участка шарнира в другом. В слюне и содержимом толстых кишок человека представлены протеолитические ферменты, способные расщеплять IgA1 именно в дублированной части цепи. Кроме того, подобной же активностью обладают протеолитические ферменты некоторых бактерий, таких как Streptococcus sanguis , Neisseria gonorrhoeae , N.meningitidis . В то же время делеция 13 аминокислот у IgA2 в данном месте шарнира обеспечивает устойчивость этого подкласса IgA по отношению к бактериальному протеолизу ( рис. 2.15 ). Вероятно, IgA2 эволюционно возник в результате способности избегать бактериального ферментативного разрушения. Благоприобретенность подобного признака кажется очевидной. На рис. 2.16 указаны домены, с которыми связаны изо- и аллотипические характеристики.
Структурной особенностью IgA является наличие в молекуле J-цепи и секреторного компонента ( рис. 2.17 ).
J-цепь IgA , как и у IgM , служит для полимеризации молекулы. Молекулярная масса цепи незначительна и составляет около 15 кД. Данный полипептид не имеет гомологии с иммуноглобулинами, а кодирующий его ген локализован в хромосоме, не содержащей гены иммуноглобулинов. На заключительном этапе синтеза J-цепь взаимодействует с СOOH-концевым участком тяжелой цепи через дисульфидные связи. В результате образуются полимерные формы IgA, представляющие собой в основном димеры, хотя в незначительном количестве имеются и мультимерные молекулы, включающие три и более мономера.
Для IgA, представленного в секретах, характерно наличие секреторного компонента (СК) . Он состоит из нескольких родственных в антигенном отношении полипептидов и экспрессируется на поверхности эпителиальных клеток . При специфическом взаимодействии димера (IgA)2-J с секреторным компонентом на клеточной поверхности образуется комплекс, который после эндоцитоза перемещается в цитоплазме к апикальной части клетки. Здесь комплекс подвергается действию протеолитических ферментов, что позволяет ему высвобождаться в секреты субэпителиального пространства ( рис. 2.18 ).
Из основной циркуляции IgA проникает в эпителиальные клетки, взаимодействуя с секреторным компонентом, который на этом этапе транспорта выполняет функцию рецептора. В самой эпителиальной клетке секреторный компонент защищает IgA от действия протеолитических внутриклеточных ферментов. Достигнув апикальной поверхности клетки, комплекс IgA:СК ( sIgA ) выходит в секрет субэпителиального пространства.
Функционально IgA выступает в качестве первой линии защиты на слизистых поверхностях, препятствуя проникновению вирусов в организм. Хотя IgA не связывает комплемент и в силу этого не обладает бактерицидной активностью, он играет важную роль в нейтрализации бактериальных токсинов. Кроме того, у млекопитающих, включая человека, секреторный IgA хорошо представлен в молозиве и обеспечивает таким образом специфический иммунитет новорожденных .
Изолированный дефицит IgA - самая частая форма первичного иммунодефицита .
Молекула IgA ( альфа-класс тяжелых цепей) может иметь одну или две субъединицы. Кроме этих форм в организме в небольших количествах присутствуют тримеры и высшие полимерные формы IgA.
В сыворотке крови IgA существует, в основном, в виде мономера (четырехцепочечной структуры), концентрация IgA в сыворотке сравнительно высока, биологическая функция до конца не установлена ( рис.20 ).
IgA ингибирует связывание нагруженных Ig микроорганизмов с поверхностью клеток слизистых оболочек и предотвращает проникновение микроорганизмов в ткани. Агрегированные иммуноглобулины соединяются с нейтрофилами и могут запустить альтернативный путь активации комплемента , который, возможно, обусловливает возникновение синергизма между IgA, комплементом и лизоцимом при уничтожении конкретных колиформных организмов.
IgE
Молекулы IgE ( эпсилон класс тяжелых цепей) состоят из одной субъединицы. Так же как и в IgM , тяжелая цепь IgE имеет 4 константных домена. IgE представляет собой мономер с мол. весом около 190 кД, включающий две тяжелые цепи ( эпсилон-цепи ) и две легкие цепи ( каппа-цепи или лямбда-цепи ). Эпсилон-цепь , как и мю-цепь , содержит пять доменов : один Vэпсилон- и четыре Сэпсилон-домена : Cэпсилон1 , Cэпсилон2 , Cэпсилон3 и Cэпсилон4 . Подклассов IgЕ человека пока не обнаружено.
Концентрация IgE в сыворотке крови невелика, и лишь небольшая часть плазматических клеток слизистых оболочек и дренирующих их лимфоузлов синтезирует иммуноглобулины этого класса. Поэтому неудивительно, что на сегодняшний день обнаружено всего 6 вариантов миеломных IgE, в то время как для IgG известны десятки тысяч случаев парапротеинемии . При подкожной инъекции человеку IgE задерживается в коже на длительное время, вероятно, связываясь с тучными клетками. Взаимодействие с антигеном приводит к дегрануляции тучных клеток и сопровождается высвобождением вазоактивных аминов. Этот процесс обусловливает симптомы сенной лихорадки и бронхиальной астмы при контакте с аллергеном у людей, страдающих аллергией .
Концентрация IgE в сыворотке возрастает при аллергических реакциях немедленного типа ( табл. 2.4 ). Высокоаффинные рецепторы к Fc-фрагменту IgE находятся на тучных клетках и базофилах . При связывании IgE, фиксированных на мембранах тучных клеток или базофилов, с антигеном происходит высвобождение медиаторов воспаления (сероборан , гистамин). Именно этот механизм лежит в основе патогенеза анафилактических реакций .
Основная физиологическая функция IgE, очевидно, защита внешних слизистых оболочек организма путем локальной активации факторов плазмы и эффекторных клеток благодаря индукции острой воспалительной реакции . Инфекционные агенты, способные прорвать линию обороны, образованную IgA , будут связываться со специфическими IgE на поверхности тучных клеток, в результате чего последние получат сигнал к высвобождению вазоактивных аминов и хемотаксических факторов, а это, в свою очередь, вызовет приток циркулирующих в крови IgG, комплемента , нейтрофилов и эозинофилов . В этих условиях способность эозинофилов повреждать гельминтов , нагруженных IgG , и усиленная продукция IgE в ответ на проникновение этих паразитов в организм будут обеспечивать эффективную защиту. Активность IgE проявляется в развитии аллергических реакций . Данный иммуноглобулин способен взаимодействовать с тучными клетками и базофилами посредством Fc-области и соответствующего рецептора на этих клетках. После образования связи IgE с антигеном (аллергеном) тучные клетки получают сигнал к секреции вазоактивных аминов и других фармакологически значимых соединений, что, собственно, и приводит к развитию аллергической реакции.
Содержание иммуноглобулина E в сыворотке исчезающе мало, но он выявляется на поверхностной мембране базофилов и тучных клеток . Удельный вес этих иммуноглобулинов в аллергических реакциях является доминирующим (например, при бронхиальной астме и сенной лихорадке ).
Этот класс составляет менее 1% всех иммуноглобулинов плазмы, но обильно представлен на мембране многих B-клеток совместно с мономерным IgM . Молекулы IgD ( дельта-класс тяжелых цепей) состоят из одной субъединицы.
IgD
Иммуноглобулин D был открыт как необычный миеломный белок . Затем его обнаружили в сыворотке крови в очень небольшом количестве. Тяжелая цепь IgD представлена дельта-цепью . У человека дельта-цепь включает три C-домена ( Cдельта1 , Cдельта2 и Cдельта3 ) в отличие от IgD мышей, содержащего только два С-домена: Сдельта1 и Сдельта3. Приводит ли делеция домена Сдельта2 к изменению функции IgD мыши, неизвестно. Шарнирная область иммуноглобулинов класса D отличается особой протяженностью (64 аминокислотных остатка - содержащую множество O-гликозидных цепей), и, хотя она в некоторой степени защищена углеводами, возможно, именно благодаря ей IgD по сравнению с другими классами иммуноглобулинов обладает повышенной чувствительностью к протеолитическому расщеплению, а период его полураспада в плазме крови очень невелик (2,8 сут.). Неожиданным оказался тот факт, что почти весь IgD вместе с IgM находится на поверхности лимфоцитов крови . Похоже, они служат антигенсвязывающими рецепторами B-лимфоцитов , и, возможно, что эти антигенные рецепторы могут взаимодействовать между собой, осуществляя контроль за активацией лимфоцитов и супрессией лимфоцитов . Возрастающая чувствительность IgD к протеолизу после связывания с антигеном может объясняться этими функциями.
Вопрос о конкретной форме участия IgD в иммунных процессах остается открытым. Предположительно он участвует в антиген-зависимой дифференцировке лимфоцитов. Подклассов IgD человека пока не обнаружено.
56. Динамика антителообразования. первичный и вторичный иммунный ответ. Иммунологическая память.
Иммунологическая память
Иммунологическая память – способность организма отвечать на повторное введение антигена быстрым повышением титра антител или пролиферацией активных лимфоцитов. Формируется благодаря клеткам памяти Т- и В-лимфоцитов. Проявляется как ускоренный специфический ответ на повторное введение антигена. Постоянная рециркуляция лимфоцитов памяти способствует их мобильности и повсеместному распространению в организме для быстрого опознания Аг. Большая продолжительность жизни клеток памяти (причина – экспрессия ингибиторов апоптоза) обеспечивает длительное сохранение приобретенного иммунитета. Феномен иммунологической памяти используется в практике вакцинации людей. Лежит в основе аллергических заболеваний, в основе гемолитической болезни новорожденных (при резус-конфликте).
Иммунологическая толерантность – состояние ареактивности клеток к определенным антигенам. Иммунологическая толерантность характеризуется:
Отсутвием ответа на антиген;
Отсутствием элиминации антигена при повторном его введении;
Отсутствием
Иммунная толерантность:
Физиологическая – толерантность к собственным антигенам.
Патологическая – толерантность к чужеродным антигенам чаще всего бактериям, вирусам, паразитам, клеткам злокачественных опухолей или трансплантата;
Мезанизмы патологической толерантности:
Чрезмерное повышение активности Т-супрессоров;
Ингибирование или блокада цитотоксических реакций клеточного иммунитета на соответсвующие Аг (чаще клеток опухоли);
Перегрузка иммунокомпетентных клеток или иммуницитов избытком образующихся в организме или водимых из вне Аг.
Искусственная ( медицинская, индуцированная) – толерантность, воспроизводимая при помощи воздейтсвий, подавляющих активность иммунной системы.
Способность к образованию антител появляется во внутриутробном периоде у 20-недельного эмбриона; после рождения начинается собственная продукция иммуноглобулинов, которая увеличивается до наступления зрелого возраста и несколько снижается к старости. Динамика образования антител имеет различный характер в зависимости от силы антигенного воздействия (дозы антигена), частоты воздействия антигена, состояния организма и его иммунной системы. При первичном и повторном введении антигена динамика антителообразования также различна и протекает в несколько стадий. Выделяют латентную, логарифмическую, стационарную фазу и фазу снижения.
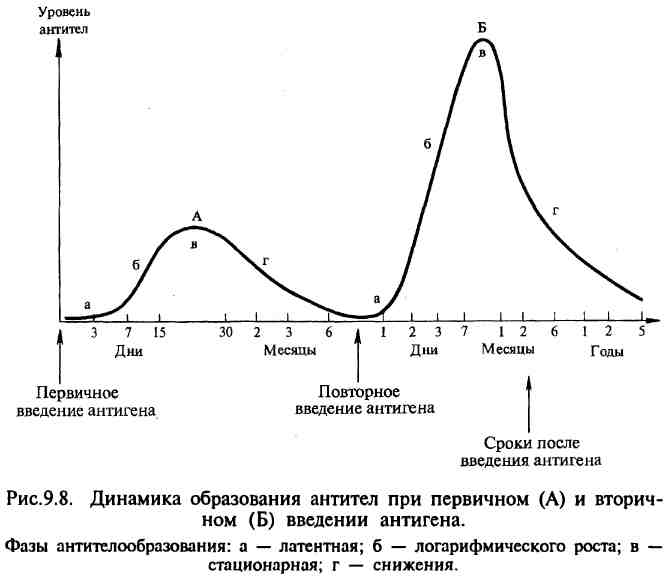
В латентной фазе происходят переработка и представление антигена иммунокомпетентным клеткам, размножение клона клеток, специализированного на выработку антител к данному антигену, начинается синтез антител. В этот период антитела в крови не обнаруживаются.
Во время логарифмической фазы синтезированные антитела высвобождаются из плазмоцитов и поступают в лимфу и кровь.
В стационарной фазе количество антител достигает максимума и стабилизируется, затем наступает фаза снижения уровня антител. При первичном введении антигена (первичный иммунный ответ) латентная фаза составляет 3—5 сут, логарифмическая — 7— 15 сут, стационарная — 15—30 сут и фаза снижения — 1—6 мес и более. Особенностью первичного иммунного ответа является то, что первоначально синтезируется IgM, а затем IgG.
В отличие от первичного иммунного ответа при вторичном введении антигена (вторичный иммунный ответ) латентный период укорочен до нескольких часов или 1—2 сут, логарифмическая фаза характеризуется быстрым нарастанием и значительно более высоким уровнем антител, который в последующих фазах длительно удерживается и медленно, иногда в течение нескольких лет, снижается. При вторичном иммунном ответе в отличие от первичного синтезируются главным образом IgG.
Такое различие динамики антителообразования при первичном и вторичном иммунном ответе объясняется тем, что после первичного введения антигена в иммунной системе формируется клон лимфоцитов, несущих иммунологическую память о данном антигене. После повторной встречи с этим же антигеном клон лимфоцитов с иммунологической памятью быстро размножается и интенсивно включает процесс антителогенеза.
Очень быстрое и энергичное антителообразование при повторной встрече с антигеном используется в практических целях при необходимости получения высоких титров антител при производстве диагностических и лечебных сывороток от иммунизированных животных, а также для экстренного создания иммунитета при вакцинации.
57.Формы иммунного ответа
Основная функция иммунной системы это поддержание антигенного гомеостаза (постоянства) организма. Состояние невосприимчивости к определенному типу микроорганизмов их токсинам или ядам животных называется иммунитетом. При участии иммунной системы распознаются и разрушаются все генетически чужеродные структуры: вирусы, бактерии, грибы, паразиты, опухолевые клетки. Реакция организма человека на внедрение инфекции или яда носит название иммунного ответа. В процессе эволюции свойства микроорганизмов постоянно совершенствовались (этот процесс происходит и сейчас) – это привело к появлению различных видов иммунитета.
Кроме иммунной системы в защите организма принимают участие другие структуры и факторы, которые препятствуют проникновению микробов. Такими структурами являются, например, кожа (здоровая кожа практически непроницаема для большинства микробов и вирусов), движение ресничек эпителия дыхательных путей, слой слизи, покрывающий слизистые оболочки, кислая среда желудка и пр.
Типы иммунитета Различаем два основных типа иммунитета: видовой (наследственный) и индивидуальный (приобретенный). Видовой иммунитет одинаков у всех представителей определенного вида животных. Видовой иммунитет человека делает его невосприимчивым по отношению ко многим заболеваниям животных (например, чуме собак), с другой стороны многие животные невосприимчивы к болезням людей. Основу видового иммунитета, видимо, составляет различие микроструктуры. Видовой иммунитет передается по наследству от одного поколения к другому.
Индивидуальный иммунитет формируется на протяжении жизни каждого человека и не передается последующим поколениям. Формирование индивидуального иммунитета происходит, как правило, во время различных инфекционных заболеваний (или отравлений), однако не все болезни оставляют после себя стабильный иммунитет. Так например, после перенесенной гонорей иммунитет очень непродолжителен и слаб, поэтому это заболевание может возникнуть вновь спустя некоторое время после очередного контакта с микробом. Другие заболевания, как, например, ветряная оспа, оставляют стабильный иммунитет, который предотвращает повторное заболевание на протяжении всей жизни. Длительность иммунитета определяется главным образом иммуногенностью микроба (способность вызывать иммунный ответ).
Иммунитет, приобретенный после перенесенного инфекционного заболевания, называется натуральным активным, а после вакцинации – искусственным активным. Эти два типа иммунитета наиболее продолжительны. Во время беременности мать передает плоду часть своих антител, которые защищают ребенка в первые месяцы жизни. Такой иммунитет называется натуральным пассивным. Искусственный пассивный иммунитет развивается при введении человеку сыворотки содержащей антитела против определенного микроба или его яда. Такой иммунитет длится несколько недель, а затем бесследно исчезает.
Стерильный и нестерильный иммунитет Как уже упоминалось выше, состояние иммунитета (то есть невосприимчивости к определенному типу антигена) возникает после перенесенной инфекции. В результате иммунного ответа большая часть микроорганизмов, поникнувших в организм, разрушается. Однако полное выведение микробов из организма происходит не всегда. При некоторых инфекционных заболеваниях (например, при туберкулезе), часть микробов остаются блокированными в организме. При этом микробы теряют агрессивность и способность активно размножаться. В таких случаях возникает, так называемый нестерильный иммунитет, который поддерживается постоянным присутствием в организме небольшого количества микробов. При нестерильном иммунитете существует возможность реактивации инфекции (так происходит в случае герпеса), на фоне временного снижения функции иммунной системы. Однако в случае реактивации болезнь быстро локализуется и подавляется, так как организм уже приспособился бороться с ней.
Стерильный иммунитет характеризуется полным устранением микробов из организма (например, при вирусном гепатите А). Стерильный иммунитет возникает также при вакцинации.
Виды иммунного ответа Как уже говорилось выше, иммунный ответ представляет собой реакцию организма на внедрение в него микробов или различных ядов. В целом, любое вещество, чья структура отличается от структуры тканей человека способно вызвать иммунный ответ. Исходя из механизмов, задействованных в его реализации, иммунный ответ может быть различным.
Во-первых, различаем специфический и неспецифический иммунный ответ. Неспецифический иммунный ответ - это первый этап борьбы с инфекцией он запускается сразу же после попадания микроба в наш организм. В его реализации задействованы система комплимента, лизоцим, тканевые макрофаги. Неспецифический иммунный ответ практически одинаков для всех типов микробов и подразумевает первичное разрушение микроба и формирование очага воспаления. Воспалительная реакция это универсальный защитный процесс, который направлен на предотвращение распространения микроба. Неспецифический иммунитет определяет общую сопротивляемость организма. Люди с ослабленным иммунитетом чаще болеют различными заболеваниями.
Специфический иммунитет это вторая фаза защитной реакции организма. Основной характеристикой специфического иммунного ответа является распознавание микроба и выработка факторов защиты направленных специально против него. Процессы неспецифического и специфического иммунного ответа пересекаются и во многом дополняют друг друга. Во время неспецифического иммунного ответа часть микробов разрушается, а их части выставляются на поверхности клеток (например, макрофагов). Во второй фазе иммунного ответа клетки иммунной системы (лимфоциты) распознают части микробов, выставленные на мембране других клеток, и запускают специфический иммунный ответ как таковой. Специфический иммунный ответ может быть двух типов: клеточный и гуморальный.
Клеточный иммунный ответ подразумевает формирование клона лимфоцитов (К-лимфоциты, цитотоксические лимфоциты), способных разрушать клетки мишени, мембраны которых содержат чужеродные материалы (например, вирусные белки).
Клеточный иммунитет задействован в ликвидации вирусной инфекции, а также таких типов бактериальных инфекций как туберкулез, проказа, риносклерома. Раковые клетки тоже разрушаются активированными лимфоцитами.
|
Гуморальный иммунный ответ опосредован В-лимфоцитами, которые после распознания микроба начинают активно синтезировать антитела по принципу один тип антигена – один тип антитела. На поверхности одного микроба может быть множество различных антигенов, поэтому обычно вырабатывается целая серия антител, каждое из которых при этом направлено на определенный антиген. Антитела (иммуноглобулины, Ig) – это молекулы белков, способные прилипать к определенной структуре микроорганизма, вызывая его разрушение или скорейшее выведение из организма. Теоретически возможно формирование антител против любого химического вещества, имеющего достаточно большую молекулярную массу. Существует несколько типов иммуноглобулинов, каждый из которых выполняет специфическую функцию. Иммуноглобулины типа А (IgA) синтезируются клетками иммунной системы и выводятся на поверхность кожи и слизистых оболочек. В больших количествах IgA содержатся во всех физиологических жидкостях (слюна, молоко, моча). Иммуноглобулины типа А обеспечивают местный иммунитет, препятствуя проникновению микробов через покровы тела и слизистые оболочки.
Иммуноглобулины типа M (IgM) выделяются в первое время после контакта с инфекцией. Эти антитела представляют собой большие комплексы способные связывать сразу несколько микробов одновременно. Определение IgM в крови является признаком развития в организме острого инфекционного процесса.
Антитела типа G (IgG) появляются вслед за IgM и представляют собой основной фактор гуморального иммунитета. Этот тип антител защищает организм на протяжении длительного времени от различных микроорганизмов.
Иммуноглобулины типа Е (IgE) участвуют в развитии аллергических реакций немедленного типа, тем самым защищая организм от проникновения микробов и ядов через кожу.
Антитела вырабатываются во время всех инфекционных болезней. Период развития гуморального иммунного ответа составляет примерно 2 недели. За это время в организме вырабатывается достаточное количество антител для нейтрализации инфекции.
Клоны цитотоксических лимфоцитов и В-лимфоцитов сохраняются в организме длительное время и при новом контакте с микроорганизмом запускают мощный иммунный ответ. Присутствие в организме активированных иммунных клеток и антител против определенных типов антигенов носит название сенсибилизация. Сенсибилизированный организм способен быстро ограничивать распространение инфекции, предупреждая развитие болезни.
Сила иммунного ответа Сила иммунного ответа зависит от реактивности организма, то есть от его способности реагировать на внедрение инфекции или ядов. Различаем несколько типов иммунного ответа в зависимости от его силы: нормоэргический, гипоэргический и гиперэргический (от греч. ergos – сила).
Нормоэргический ответ– соответствует силе агрессии со стороны микроорганизмов и приводит к их полному устранению. При нормоэргическом иммунном ответе повреждение тканей в ходе воспалительной реакции умеренно и не вызывает серьезных последствий для организма. Нормоэргический иммунный ответ характерен для людей с нормальной функцией иммунной системы.
Гипоэргический ответ– слабее агрессии со стороны микроорганизмов. Поэтому при таком типе ответа распространение инфекции ограничивается не полностью, а само инфекционное заболевание переходит в хроническую форму. Гипоэргический иммунный ответ характерен для детей и пожилых людей (у этой категории людей иммунная система работает недостаточно в силу возрастных особенностей), а также у лиц с первичными и вторичными иммунодефицитами.
Гиперэргический иммунный ответ развивается на фоне сенсибилизации организма по отношению к какому-либо антигену. Сила гиперэргического иммунного ответа во многом превышает силу агрессии микробов. В ходе гиперэргического иммунного ответа воспалительная реакция достигает значительных значений, что приводит к повреждению здоровых тканей организма. Возникновение гиперэргического иммунного ответа определяется особенностями микроорганизмов и конституциональными характеристиками самой иммунной системы организма. Гиперэргические иммунные реакции лежат в основе формирования аллергии.
58. Гиперчувствительность немедленного и замеленного типа
(ГНТ) —гиперчувствительность, обусловленная антителами против аллергенов. Развивается через несколько минут или часов после воздействия аллергена: расширяются сосуды, повышается их проницаемость, развиваются зуд, бронхоспазм, сыпь, отеки. К ГНТ относятся I тип — анафилактический, II тип — цитотоксический, III тип — иммунокомплексный, аллергических реакций
Основные типы реакций гиперчувствительности: I тип — анафилактический. Клинические проявления гиперчувствительности I типа могут протекать на фоне атопии. Атопия — наследственная предрасположенность к развитию ГНТ, обусловленная повышенной выработкой IgE-антител к аллергену, Анафилактический шок — протекает остро с развитием коллапса, отеков, спазма гладкой мускулатуры; часто заканчивается смертью. Крапивница — увеличивается проницаемость сосудов, кожа краснеет, появляются пузыри, зуд. Бронхиальная астма — развиваются воспаление, бронхо-спазм, усиливается секреция слизи в бронхах. II тип — цитотоксический. Время реакции — минуты или часы. По II типу гиперчувствительности развиваются некоторые аутоиммунные болезни, обусловленные появлением аутоантител к антигенам собственных тканей: злокачественная миастения, аутоиммунная гемолитическая анемия, вульгарная пузырчатка, синдром Гудпасчера, аутоиммунный гипертиреоидизм, инсулинозависимый диабет II типа. Клинические проявления III типа. Сывороточная болезнь происходит при введении высоких доз антигена, например лошадиной противостолбнячной сыворотки. Развиваются системные васкулиты, артриты (отложение комплексов в суставах), нефрит (отложение комплексов в почках).
Гиперчувствительность замедленного типа
возникать при сенсибилизации организма:
1.Микроорганизмами и микробными анти-генами (бактериальными, грибковыми, протозойными, вирусными); 2. Гельминтами; 3. Природными и искусственно синтезированными гаптенами (лекарственные препараты, красители); 4. Некоторыми белками.
Следовательно, реакция замедленного типа может вызываться практически всеми антигенами. При этом реакцию вызывают малые дозы антигенов и лучше всего при внутрикожном введении. Морфологическая картина при аллергиях клеточного типа носит воспалительный характер, обусловленный реакцией лимфоцитов и макрофагов на образующийся комплекс антигена с сенсибилизированными лимфоцитами. Аллергические реакции клеточного типа проявляются в виде туберкулиновой реакции, замедленной аллергии к белкам, контактной аллергии. Туберкулиновая реакция возникает через 5—6 ч после внутрикожного введения антигенов туберкулезной палочки. Выражается реакция в виде покраснения, припухлости, уплотнения на месте введения туберкулина. Сопровождается иногда повышением температуры тела, лимфопенией. Развитие реакции достигает максимума через 24—48 ч. Замедленная аллергия возникает не раньше чем через 5 дней и длится 2—3 нед. Контактная аллергия возникает при длительном контакте с химическими веществами, в том числе фармацевтическими препаратами, красками, косметическими препаратами. Проявляется контактная аллергия в виде всевозможных дерматитов, т. е. поражений поверхностных слоев кожи.
59. Анафилактический шок и сывороточная болезнь. Методы их предупреждения.
Анафилаксия представляет собой реакцию немедленного типа, возникающую при парентеральном повторном введении антигена в ответ на повреждающее действие комплекса антиген — антитело и характеризующуюся стереотипно протекающей клинической и морфологической картиной.
Основную роль в анафилаксии играет цитотропный IgE, имеющий сродство к клеткам, в частности базофилам и тучным клеткам. После первого контакта организма с антигеном образуется IgE, который вследствие цитотропности адсорбируется на поверхности названных выше клеток. При повторном попадании в организм этого же антигена IgE связывает антиген с образованием на мембране клеток комплекса IgE — антиген. Комплекс повреждает клетки, которые в ответ на это выделяют медиаторы — гистамин и гистаминоподобные вещества (серотонин, кинин). Эти медиаторы связываются рецепторами, имеющимися на поверхности функциональных мышечных, секреторных, слизистых и других клеток, вызывая их соответствующие реакции. Это ведет к сокращению гладкой мускулатуры бронхов, кишечника, мочевого пузыря, повышению проницаемости сосудов и другим функциональным и морфологическим изменениям, которые сопровождаются клиническим проявлением. Клинически анафилаксия проявляется в виде одышки, удушья, слабости, беспокойства, судорог, непроизвольного мочеиспускания, дефекации и др. Анафилактическая реакция протекает в три фазы: в 1-й фазе происходит сама реакция антиген — антитело; во 2-й фазе выделяются медиаторы анафилактической реакции; в 3-й фазе проявляются функциональные изменения.
Анафилактическая реакция возникает спустя несколько минут или часов после повторного введения антигена. Протекает в виде анафилактического шока или как местные проявления. Интенсивность реакции зависит от дозы антигена, количества образующихся антител, вида животного и может закончиться выздоровлением или смертью. Анафилаксию легко можно вызвать в эксперименте на животных. Оптимальной моделью для воспроизведения анафилаксии является морская свинка. Анафилаксия может возникать на введение любого антигена любым способом (подкожно, через дыхательные пути, пищеварительный тракт) при условии, что антиген вызывает образование иммуноглобулинов. Доза антигена, вызывающая сенсибилизацию, т. е. повышенную чувствительность, называется сенсибилизирующей. Она обычно очень мала, так как большие дозы могут вызвать не сенсибилизацию, а развитие иммунной защиты. Доза антигена, введенная уже сенсибилизированному к нему животному и вызывающая проявление анафилаксии, называется разрешающей. Разрешающая доза должна быть значительно больше, чем сенсибилизирующая.
Состояние сенсибилизации после встречи с антигеном сохраняется месяцами, иногда годами; интенсивность сенсибилизации можно искусственно уменьшить введением малых разрешающих доз антигена, которые связывают и выводят из циркуляции в организме часть антител. Этот принцип был использован для десенсибилизации (гипосенсибилизации), т.е. предупреждения анафилактического шока при повторных введениях антигена. Впервые способ десенсибилизации предложил русский ученый А. Безредка (1907), поэтому он называется способом Безредки. Способ состоит в том, что человеку, ранее получавшему какой-либо антигенный препарат (вакцину, сыворотку, антибиотики, препараты крови и др.), при повторном введении (при наличии у него повышенной чувствительности к препарату) вначале вводят небольшую дозу (0,01; 0,1 мл), а затем, через 1—1'/2 ч, — основную. Таким приемом пользуются во всех клиниках для избежания развития анафилактического шока; этот прием является обязательным.
Возможен пассивный перенос анафилаксии с антителами.
Предупреждение развития анафилактического шока состоит, прежде всего, в полном сборе аллергологического анамнеза, в том числе и наследственного (наличие сопутствующих заболеваний - атопические дерматиты, бронхиальная астма, крапивница, отек Квинке на медикаменты и продукты, у детей - определение аллергологического анамнеза родителей). Необходимо выяснить информацию о предыдущем введении препарата, который врач намеревается применить, последствия его использования. В настоящее время существуют обоснованные предостережения по проведению аллергических проб на чувствительность к препаратам, которые могут сенсибилизировать организм или вызвать анафилаксию. При меньших подозрениях развития анафилактической реакции следует использовать общее обезболевание. У больных с аллергологическим анамнезом стоматологические вмешательства проводятся в условиях стационара после предварительного введения десенсибилизирующих препаратов.
Сывороточной болезнью называют реакцию, возникающую при разовом парентеральном введении больших доз сывороточных и других белковых препаратов. Обычно реакция возникает спустя 10—15 сут. Механизм сывороточной болезни связан с образованием антител против введенного чужеродного белка (антигена) и повреждающим действием на клетки комплексов антиген — антитело. Клинически сывороточная болезнь проявляется отеком кожи и слизистых оболочек, повышением температуры тела, при-пуханием суставов, сыпью и зудом кожи; наблюдаются изменения в крови (увеличение СОЭ, лейкоцитоз и др.). Сроки проявления и тяжесть сывороточной болезни зависят от содержания циркулирующих антител и дозы препарата. Это объясняется тем, что ко 2-й неделе после введения белков сыворотки вырабатываются антитела к белкам сыворотки и образуется комплекс антиген — антитело. Профилактика сывороточной болезни осуществляется по способу Безредки
Осложнениями сывороточной болезни могут быть миокардит, гепатит, гломерулонефрит, моно- или полиневрит, энцефалит. При отсутствии поздних тяжелых осложнений со стороны внутренних органов прогноз заболевания, как правило, благоприятный.
В соответствии с тяжестью заболевания назначают внутрь или в виде инъекций антигистаминные препараты, а также на курс 7-14 дней глюко-кортикоидные гормоны, необходимые для предупреждения поздних осложнений со стороны внутренних органов. Курс начинают с 20-30 мл преднизолона в сутки. При отеке гортани и абдоминальном синдроме показано подкожное введение 0,5 мл 0,1%-ного раствора адреналина с 1 мл 5%-ного раствора эфедрина.
Помимо этого, внутримышечно вводят 30 мг преднизолона или 125 мг гидрокортизона. Для предупреждения повторного возникновения сывороточной болезни или сывороточноподобных реакций больному рекомендуется пройти тщательное обследование под руководством врача-аллерголога и с помощью кожных или провокационных проб установить аллерген, спровоцировавший заболевание.
Перед введением чужеродной сыворотки сначала ставится скарификационная проба с разведением сыворотки 1 : 100 и 1 : 10. Если по истечении 20 минут у больного появился кожный зуд, единичные или распространенные высыпания, дальнейшее введение сыворотки недопустимо. При отрицательных результатах разрешается поставить внутрикожную пробу при разведении 1 : 100 и 1 : 10в объеме 0,2 мл. Если больному требуется введение противостолбнячной сыворотки, а в его анамнезе имеются указания на какие-либо аллергические реакции, рекомендуется использовать анатоксин бычий столбнячный или иммуноглобулин человеческий противостолбнячный, который получают из сыворотки крови человека, иммунизированного столбнячным токсином.
60. Кожно-аллергические пробы и их использование в диагностике инфекционных болезней.
Аллергические диагностические пробы
методы диагностики аллергии. Проводятся после того, как путем тщательного сбора анамнеза выявлен круг подозреваемых аллергенов. Пробы выполняют вне фазы обострения заболевания и не раньше чем через 2—3 нед. после перенесенной острой аллергической реакции, т.к. чувствительность организма к аллергену в течение этого времени снижается.
Различают кожные и провокационные А. д. п. Кожные пробы основаны на выявлении специфической сенсибилизации организма путем введения аллергена через кожу. При этом оценивают величину и характер развивающейся воспалительной реакции. Различают качественные и количественные кожные пробы. С помощью качественных кожных проб определяют наличие или отсутствие сенсибилизации к данному аллергену. Эти пробы используют при диагностике аллергических, а также некоторых инфекционно-аллергических (туберкулеза, бруцеллеза и др.) и паразитарных (гельминтозов) болезней. Количественные кожные пробы позволяют получить представление о степени сенсибилизации организма. С их помощью определяют минимальную концентрацию специфического аллергена, при которой он вызывает в сенсибилизированном организме видимую аллергическую реакцию. Этот метод называется аллергометрическим титрованием. С его помощью устанавливают дозу аллергена, с которой можно начинать специфическую гипосенсибилизацию (снижение уровня сенсибилизации) путем введения в организм аллергена.
В зависимости от методики проведения кожные пробы могут быть прямыми и непрямыми. При прямых кожных пробах аллерген вводят внутрикожно или повреждая эпидермис путем укола, царапины. При капельных и аппликационных прямых кожных пробах аллерген (обычно лекарственный препарат или вещество) наносят на неповрежденную кожу в виде капли или аппликации. Ответная кожная реакция считается положительной при появлении гиперемии, инфильтрации или волдыря. Она может возникнуть в течение 20 мин (немедленная реакция), через 6—12 ч (реакция переходного типа), через 24—48 ч(замедленная реакция). Тип ответной кожной реакции зависит от характера иммунологического механизма аллергической реакции. Среди прямых кожных проб различных видов наиболее чувствительной является внутрикожная, затем следуют скарификационная, укол, аппликационная, капельная.
К непрямым кожным пробам относится реакция Прауснитца — Кюстнера, при которой сыворотку крови больного вводят внутрикожно здоровому человеку и после фиксации антител на коже реципиента (через 24 ч) в то же место вводят аллерген. По развитию местной кожной реакции судят о наличии антител-реагинов в исследуемой сыворотке. Данная реакция не исключает возможности переноса с сывороткой крови возбудителя при наличии скрытой инфекции у донора, поэтому применение ее ограничено. Наиболее целесообразно выявлять антитела-реагины с помощью различных реакций иммунитета — иммуноферментного метода и др. Выбор вида кожной пробы зависит от заболевания, предполагаемой степени чувствительности, характера аллергена, а также от реактивности кожи. Прием некоторых лекарственных препаратов (антигистаминных, седативных средств) резко уменьшает реактивность кожи, поэтому перед аллергологическим обследованием необходимо в течение 5—7 дней воздержаться от приема этих лекарственных средств.
В диагностике аллергических болезней нельзя полностью полагаться на кожные пробы и переоценивать их результаты. Постановку кожных проб и оценку их результатов проводит только специально обученный медперсонал.
При несоответствии данных аллергологического анамнеза и результатов кожных проб в период ремиссии показаны провокационные пробы. Эти пробы основаны на воспроизведении аллергических реакций введением аллергена в орган или ткань, поражение которых является ведущим в картине заболевания. Различают конъюнктивальные, назальные и ингаляционные провокационные пробы. Конъюнктивальная провокационная проба проводится путем закапывания аллергена в нижний конъюнктивальный мешок. Реакция считается положительной при появлении гиперемии конъюнктивы, слезотечения и зуда век. Назальную провокационную пробу осуществляют при аллергических ринитах и поллинозах: в одну половину носа закапывают аллерген, а в другую — контрольную жидкость. Реакция считается положительной при возникновении на стороне закапывания аллергена затрудненного носового дыхания и зуда. Ингаляционный провокационный тест применяют с целью этиологической диагностики бронхиальной астмы: с помощью аэрозольного распылителя больной вдыхает через рот раствор аллергена. Реакция считается положительной в случае снижения более чем на 15% жизненной емкости легких.
К провокационным пробам относятся также холодовая и тепловая пробы, используемые при холодовой и тепловой крапивнице. При отсутствии четких признаков заболевания проводят экспозиционную провокационную пробу. Она основана на непосредственном контакте больного с подозреваемым аллергеном в той среде, в которой больной обычно находится. Противоположной этой пробе является элиминационная проба — исключение из пищевого рациона предполагаемого аллергена, перевод больного, страдающего бытовой аллергией, в так называемую безаллергенную палату и др. Лейкоцитопеническую и тромбоцитопеническую провокационные пробы применяют в диагностике пищевой аллергии и лекарственной аллергии. В основе этих проб лежит снижение числа лейкоцитов и тромбоцитов в крови после введения больному испытуемого аллергена.
