
- •Раздел 5. Окислительно-восстановительные и электрохимические процессы
- •5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
- •Уравнение Нернста
- •Гальванические элементы. Химические источники тока
- •5.2 Электролиз
- •Последовательность электродных процессов
- •Законы электролиза
- •5.3. Коррозия и защита металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Факторы, влияющие на скорость электрохимической коррозии
- •Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •Заключение
Защита от коррозии на стадии эксплуатации
В процессе эксплуатации готовых изделий и конструкций их защищают от коррозии путём наложения внешнего потенциала. Это электрохимические методы, к которым относятся, например, метод протекторов и катодная защита. Уменьшить опасность коррозии можно уменьшением агрессивности среды.
Метод протекторов (лат. рrotector ─ покровитель) заключается в том, что к защищаемому металлу присоединяют достаточно массивный кусок более активного в данных условиях металла, который будет разрушаться и защищать основной металл от коррозии. Данный метод применяют для защиты от коррозии металлических конструкций, погруженных в воду (рис. 5.19), а также подземных сооружений.
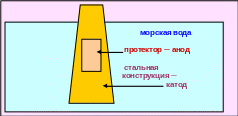
Рис. 5.19 ─ Схема протекторной защиты
Катодная защита осуществляется путём присоединения защищаемого металла к катоду внешнего источника постоянного тока, роль анода выполняет электрод из неактивного металла или стальной (чугунный) лом, который называют «жертвенным» анодом. На катоде идёт процесс восстановления окислителя из окружающей среды, а на аноде ─ окисление «жертвенного» анода или веществ из окружающей среды (рис. 5.20).
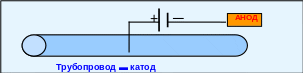
Рис. 5.20 ─ Схема катодной защиты
Протекторная и катодная защита могут быть осуществлены только в токопроводящих средах, например в водной среде или во влажной почве.
Защита путём уменьшения агрессивности среды
Агрессивность окружающей среды уменьшается путём удаления или снижения концентрации веществ, вызывающих коррозионные процессы, а также введением замедлителей (ингибиторов) коррозии.
Кислород, содержащийся в питательной воде котлов, ускоряет коррозионные процессы. Стружка из стали в фильтре, через который проходит вода, поглощает кислород и уменьшает агрессивность среды.
Ингибиторы ─ вещества, замедляющие коррозионный процесс. Механизм действия большинства ингибиторов имеет электрохимическую природу и заключается в адсорбции на корродирующей поверхности и последующем преимущественном торможении анодных или катодных процессов.
Заключение
Электрохимические процессы заключаются во взаимном превращении электрической и химической энергии и делятся на два вида:
▫ заключающиеся в превращении энергии химической реакции в электрическую;
▫ протекающие под действием внешнего электрического тока и превращающие электрическую форму энергии в химическую (рис. 5.21).
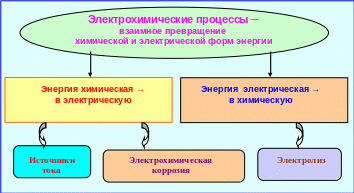
Рис. 5.21 ─ Схема превращения форм энергии в электрохимических процессах
В любом электрохимическом процессе можно выделить анодный процесс окисления восстановителя и катодный процесс восстановления окислителя (табл. 5.5).
Таблица 5.5
Примеры электрохимических процессов

Основная литература:
1. Коровин Н.В. Общая химия. М.: Высшая школа, 2008. – 557 с. §§ 9.1– 9.3, 9.6
2. Глинка Н.Л. Общая химия. Л.: Химия, 1983. – 704 с. Глава IX.
