
- •Раздел 5. Окислительно-восстановительные и электрохимические процессы
- •5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
- •Уравнение Нернста
- •Гальванические элементы. Химические источники тока
- •5.2 Электролиз
- •Последовательность электродных процессов
- •Законы электролиза
- •5.3. Коррозия и защита металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Факторы, влияющие на скорость электрохимической коррозии
- •Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •Заключение
Факторы, влияющие на скорость электрохимической коррозии
Скорость коррозии, как скорость гетерогенного процесса (υкорр.), определяется уменьшением массы прокорродировавшего металла (Δm ) на единицу поверхности металла ( S ) за единицу времени ( τ )
υкорр. = Δ m / S∙ τ.
Скорость разрушения металла зависит от скорости протекания как анодного, так и катодного процесса. Скорость протекания анодного процесса зависит, в основном, от свойств металла: его активности, состояния поверхности; это внутренние причины. Причины внешние определяют, в основном, скорость катодного процесса (рис. 5.15).
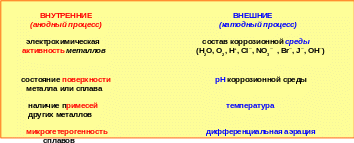
Рис. 5.14 ─ Внутренние и внешние факторы, влияющие на скорость коррозии металлов
Внутренние факторы.
1. Электрохимическая активность металла. Ряд стандартных электродных потенциалов характеризует активность металлов в стандартных условиях, т.е. в растворе собственной соли с концентрацией 1 моль /л. Реальные условия эксплуатации металлов далеки от стандартных и значения электродных потенциалов изменяются значительно. (табл. 5.4). Реальная коррозионная активность металлов может зависеть от наличия на его поверхности самопроизвольно образовавшейся защитной плёнки, это, так называемые, самопассивирующиеся металлы.
Таблица 5.4
Значения электродных потенциалов в различных средах
Слабокислая среда, рН≈6 |
Стандартные условия |
Морская вода |
|||
Металл или сплав |
Потенциал, Е, В |
Металл |
Потенциал, Е, В |
Металл или сплав |
Потенциал, Е, В |
Zn |
─0,82 |
Al |
─1,66 |
Sn |
─0,80 |
Cd |
─0,57 |
Zn |
─0,76 |
Al |
─0,67 |
Сталь |
─0,35 |
Fe |
─0,44 |
Cd |
─0,52 |
Pb |
─0,28 |
Cd |
─0,40 |
Сталь |
─0,34 |
Sn |
─0,18 |
Ni |
─0,25 |
Zn |
─0,28 |
Al |
─0,17 |
Sn |
─0,14 |
Pb |
─0,26 |
Ni |
+0,12 |
Pb |
─0,13 |
Cu |
+0,01 |
Cu |
+0,14 |
Cu |
+0,34 |
Ni |
+0,05 |
Ag |
+0,20 |
Ag |
+0,80 |
Ag |
+0,15 |
2. Состояние поверхности металла. Всевозможные нарушения структуры поверхности металла являются анодными участками и, тем самым, создают предпосылки для протекания коррозионного процесса.
3. Наличие примесей способствует увеличению скорости коррозии, т.к. создают условия для работы микрокоррозионных элементов. Если на участках примеси возникают менее отрицательные потенциалы, чем на основном металле, то разрушается этот металл. Следовательно, примеси менее активных металлов усиливают коррозионное разрушение основного металла. Чем больше разность возникающих электродных потенциалов, тем выше скорость коррозии.
Внешние факторы.
1. Состав коррозионной среды. Наибольшей коррозионной активностью обладают вода, кислород, а также ионы H+, Cl─, NO3─, Br─, J─, OH─.
2. Влияние рН коррозионной среды определяет характер катодного процесса.
Скорость коррозии зависит от химических свойств оксидной плёнки, покрывающей поверхность металла. Например, алюминий довольно устойчив в нейтральной среде, но разрушается как в кислых, так и в щелочных средах, что связано с амфотерным характером Al2O3. В то же время, скорость коррозии стали возрастает с уменьшением рН (увеличением концентрации ионов Н+) ─ рис. 5.15-а.
3. Влияние температуры. Если коррозия протекает в кислой среде с водородной деполяризацией: 2Н+ + 2ē → Н2 , то скорость коррозии возрастает с увеличением температуры. В нейтральной среде с кислородной деполяризацией: 2Н2О +О2 +2ē → 4ОН─, до температуры 800С скорость коррозии увеличивается, а затем, с уменьшением растворимости кислорода в воде она уменьшается (рис. 5.15-б).
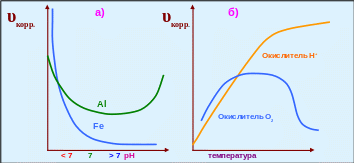
Рис. 5.15 ─ Влияние на скорость коррозии металлов а) ─ рН и б) ─ температуры
4. Неодинаковый доступ воздуха (кислорода) к поверхности металла (дифференциальная аэрация). Чаще всего в воздухе окислителем является кислород. На тех участках поверхности металла, где доступ кислорода больше, образуются пассивные плёнки, что вызывает их катодную поляризацию. и те участки поверхности металлов, где доступ кислорода больше, пассивируются и выполняют функцию катода. Непассивные, анодные участки корродируют (рис. 5.16).
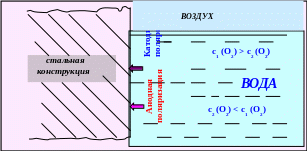
Рис. 5.16 ─ Схема распределения анодных и катодных участков на
поверхности стальной конструкции при дифференциальной аэрации
