
- •Раздел 5. Окислительно-восстановительные и электрохимические процессы
- •5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
- •Уравнение Нернста
- •Гальванические элементы. Химические источники тока
- •5.2 Электролиз
- •Последовательность электродных процессов
- •Законы электролиза
- •5.3. Коррозия и защита металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Факторы, влияющие на скорость электрохимической коррозии
- •Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •Заключение
Электрохимическая коррозия
Во влажной коррозионной среде на поверхности металла возникает скачок потенциала, в результате которого поверхность металла принимает отрицательный заряд, но процесс коррозии не пойдёт, если не будет окислителя, чтобы связывать электроны. В данном случае корродирующий металл поляризуется анодно, а поэтому нужен деполяризатор. Для обычных процессов коррозии в атмосферных условиях электроны связываются кислородом (кислородная деполяризация) или ионами водорода (водородная деполяризация):
2Н2О + О2 + 4ē → 4 ОН‾; 2Н+ + 2ē → Н2.
Электрохимическая коррозия протекает в электролитах и сопровождается возникновением коррозионного тока между анодными и катодными участками поверхности металла (рис. 5.12).
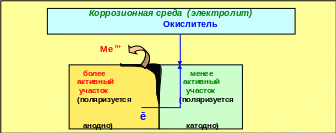
Рис. 5.12 − Схема принципа электрохимической коррозии металлов
Функцию анода выполняет более активный участок, на нём идёт окисление, в результате чего металл разрушается и его ионы «уходят» в коррозионную среду. Освободившиеся в результате окисления электроны участвуют в катодном процессе восстановления окислителя из окружающей среды. Вид процесса зависит от природы окислителя и состава среды. Для случая контакта двух металлов коррозионный процесс наиболее активно идёт в месте контакта (рис. 5.12).
В зависимости от размеров анода и катода можно выделить макро- и микрокоррозионные элементы, к первым можно отнести случаи контакта двух различных металлов, а ко вторым ─ коррозию сплавов с неоднородной структурой. Примером коррозии, сопровождающейся работой макрокоррозионного элемента, является коррозия стальных листов, соединённых медной заклёпкой (рис. 5.13).
Поверхность металлических изделий в обычных условиях имеет плёнку влаги, в которой растворяется углекислый газ из воздуха и возникает слабокислая среда:
Н2О + СО2 <══> Н2СО3 <══> Н+ + НСО3─
Реальный электродный потенциал стали в слабокислой среде равен ─0,35 В, а меди равен +0,14 В, т.о. в возникающем коррозионном элементе сталь будет выполнять функцию анода, а медная заклёпка ─ катода и схема коррозионного элемента имеет следующий вид: (Анод) Fe | Н2СО3 | Cu (Катод).
На анодных участках будет идти процесс окисления: Fe0 → Fe2+ + 2ē,
в результате которого сталь будет разрушаться.
На катодных участках будет идти восстановление окислителя, которым в кислой среде являются ионы водорода: 2Н+ + 2ē → Н2 .
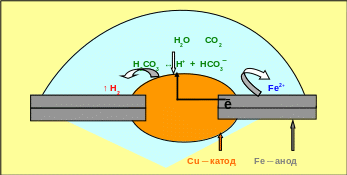
Рис. 5.13 ─ Схема электрохимической коррозии при контакте двух металлов
(макрокоррозионный элемент)
Микрокоррозионные элементы работают при коррозии стальной арматуры в железобетоне (рис. 5.14).
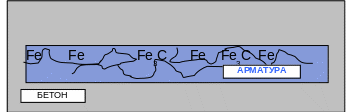
Рис. 5.14 − Схема электрохимической коррозии арматуры в железобетоне
(микрокоррозионный элемент)
В данном случае имеет значение микрогетерогенность стали: сплава железа с углеродом. Менее активные участки цементита поляризуют анодно более активные участки феррита, вследствие чего последние окисляются:
Анодный процесс: 2Fe0 → 2Fe2+ + 4ē (процесс окисления).
На окисленных участках идёт восстановительный процесс. Если во влажной атмосфере присутствует кислород, то на катодных участках происходит процесс:
Катодный процесс: 2Н2О +О2 + 4ē → 4ОН─ (процесс восстановления).
Сущность электрохимической коррозии сводится к разрушению анодных участков и восстановлению окислителя на катодных участках поверхности металла. Вторичные процессы коррозии связаны с более глубоким окислением железа, образованием гидроксида железа (III) и его частичным обезвоживанием:
О2 ОН¯ ─ Н2О
Fe2+ ─→ Fe3+ ──→ Fe (OH)3 ───→ Fe 2O3· n H2O.
Образующийся продукт Fe 2O3· n H2O обычно называют ржавчиной.
