
- •Раздел 5. Окислительно-восстановительные и электрохимические процессы
- •5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
- •Уравнение Нернста
- •Гальванические элементы. Химические источники тока
- •5.2 Электролиз
- •Последовательность электродных процессов
- •Законы электролиза
- •5.3. Коррозия и защита металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Факторы, влияющие на скорость электрохимической коррозии
- •Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •Заключение
Законы электролиза

Законы М. Фарадея являются основными законами электролиза и устанавливают количественные соотношения между прошедшим через раствор количеством электричества и количеством вещества, испытавшем химические превращения на электродах.
Пример 4.11. Вычислить массу меди, выделившейся на катоде при электролизе хлорида меди (II), проведённого при токе 10 А в течение 30 мин.
Решение. Согласно законам Фарадея:
m = (MЭ ×I× t) : 96500,
где m ─ масса вещества, окисленного или восстановленного на электроде, г;
Мэ ─ молярная масса эквивалента вещества, г/моль;
I ─ сила тока. А; t ─ время электролиза,с;
96500 ─ число Фарадея, Кл/моль (А · с/моль).
Подставим числовые значения:
m = [67 г/моль · 10 А · 30 · 60 с] : 96500 А · с / моль = 12,5 г,
где 67 г/моль = М Э (CuCl2) = (½ М CuCl2 ) = ½ · 134 г / моль.
На законе М. Фарадея основан электрохимический метод анализа (идентификации) веществ, называемый кулонометрией. Сущность анализа состоит в том, что через раствор пропускают определённое количество электричества и по изменению массы электрода определяют массу выделившегося при электролизе вещества.
5.3. Коррозия и защита металлов

Склонность металлических поверхностей к коррозии объясняется тем, что они самопроизвольно переходят в окисленное состояние, характерное для металлов в природе.
Экономический ущерб от коррозии значителен. Треть производимых чёрных металлов из-за коррозии выходит из технического употребления, причём, 10% ─ безвозвратно. Специалисты подсчитали, что на Земле за одну секунду разрушается вследствие коррозии 1,5 т металлов. Велики также затраты на антикоррозионные мероприятия.
Широкая распространённость и многообразие форм коррозии металлов связаны с их широким применением, термодинамической неустойчивостью (ΔGкорр.< 0), разнообразием свойств и условиями эксплуатации.
В зависимости от характера коррозионных разрушений различают коррозию равномерную, пятнами, точечную, межкристаллитную, избирательную (селективную), транскристаллитную (рис. 5.9).
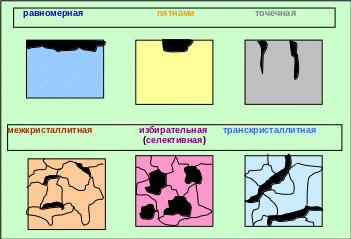
Рис. 5.9 ─ Классификация коррозии металлов по виду разрушений
По типу коррозионных процессов существует следующая классификация: химическая, электрохимическая (рис. 5.10), биохимическая. Биокоррозия вызывается деятельностью различных микроорганизмов, использующих металл как питательную среду. Примером такой коррозии может служить почвенная коррозия и коррозия в застойных водах.
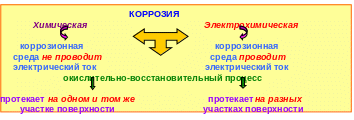
Рис. 5.10 ─ Классификация коррозионных процессов по механизму протекания
Химическая коррозия
Химическая коррозия наблюдается при контакте металлов с сухими агрессивными газами (O2, SO2, Cl2, CO) ─ газовая коррозия и с жидкими неэлектролитами (нефть и продукты её переработки) ─ жидкостная коррозия. Таким образом, химическая коррозия характерна для сред, не проводящих электрический ток (рис. 5.11).
В том случае, если агрессивным агентом является кислород, то образуются оксиды металлов. Строение оксидных плёнок зависит от химических свойств образующегося соединения и процессов диффузии окислителя или ионов металла Ме n+. В зависимости от плотности (сплошности) образующиеся оксидные плёнки могут защищать металлы от дальнейшего разрушения (самопассивирующиеся металлы) или не препятствовать коррозии, если плёнки рыхлые.
Химическая коррозия в неводных средах может быть представлена схемами:
2R ─ Cl + Me → MeCl2 + R ─ R
R1 ─ S ─ R2 + Me → MeS + R1 ─ R2.
В органических соединениях связь ковалентная, а между металлами и активными неметаллами (Cl, S) возникает ионная связь. Разрыв ковалентных и образование ионных связей легче происходит при повышенной температуре, особенно в присутствии следов воды. Такой коррозии подвергается питательная аппаратура двигателей внутреннего сгорания.
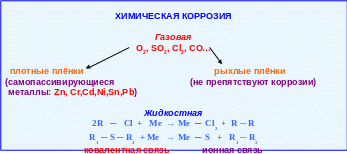
Рис. 5.11 − Особенности химической коррозии металлов
