
- •Раздел 5. Окислительно-восстановительные и электрохимические процессы
- •5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
- •Уравнение Нернста
- •Гальванические элементы. Химические источники тока
- •5.2 Электролиз
- •Последовательность электродных процессов
- •Законы электролиза
- •5.3. Коррозия и защита металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Факторы, влияющие на скорость электрохимической коррозии
- •Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •Заключение
5.2 Электролиз

В качестве примера рассмотрим электролиз расплава хлорида натрия (рис. 5.7).
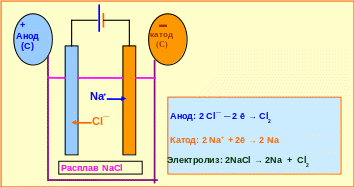
Рис. 5.7─ Сущность электролиза хлорида натрия
В расплав помещены угольные электроды, которые подключены к источнику постоянного тока. Катионы Na+ восстанавливаются на отрицательно заряженном электроде металлического натрия. Как обычно в электрохимии, электрод, на котором идёт восстановление, называется катодом, в электролизёре он имеет отрицательный знак.
На положительно заряженном электроде (аноде) идёт окисление хлорид-ионов до свободного хлора. По такой схеме получают в свободном состоянии щелочные и щелочноземельные металлы, а также галогены.
Последовательность электродных процессов
Выделение тех или иных продуктов на электродах происходит в результате окислительно-восстановительных процессов, которые в электрохимии называются процессами разряда или просто разрядом. Значение потенциала электрода, при котором происходит разряд называется потенциалом (напряжением) разложения. Из нескольких возможных процессов в первую очередь будет протекать тот, осуществление которого сопряжено с меньшей затратой энергии.
На катоде в первую очередь будут восстанавливаться те системы, потенциал разложения которых менее отрицателен (или более положителен). В случае водных растворов электролитов в электродных процессах принимает участие вода, причём, характер процесса зависит от реакции среды (табл. 5.2).
Как следует из табл. 5.2 в первом приближении, если идёт электролиз воды, то на катоде выделяется водород, а на аноде ─ кислород.
Таблица 5.2
Процессы разряда воды при электролизе
Процесс |
Реакция среды |
||
кислая |
нейтральная |
щелочная |
|
Катодный |
2Н+ + 2ē → Н2 |
2Н2О + 2ē → Н2 + 2 ОН¯ |
|
Анодный |
2Н2О → О2 + 4Н+ + 4ē |
4ОН¯→ О2 + 2Н2О + 4ē
|
|
При электролизе водных растворов солей на катоде помимо воды и ионов водорода могут разряжаться катионы металлов расположенных после титана в ряду активности, причём электролиз солей Zn, Cr, Fe, Cd, Ni cопровождается совместным выделением металла и водорода. Приближённо выделение водорода можно не учитывать (рис. 5.8).

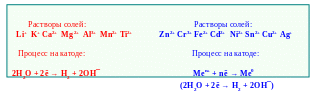
Рис. 5.8 ─ Последовательность катодных процессов при электролизе
На аноде в первую очередь будут окисляться системы с менее положительным напряжением разложения. Анодный процесс в первую очередь определяется материалом анода. Очень часто в качестве анода используют Zn, Cr, Fe, Cd, Ni, Cu, Ag, это растворимые аноды, т.е. идёт окисление анода по схеме: Ме 0 ─ n ē → Ме n+ . Применяются также нерастворимые (инертные) аноды: угольные, графитовые, платиновые. На таких анодах могут разряжаться простые анионы в следующей последовательности: S2‾, J‾ Br‾, Cl‾. Кислородсодержащие ионы, например: NO3‾, SO4‾, а также F‾ в водных растворах не разряжаются, вместо них окисляется Н2О или ОН ¯ (табл. 5.2, табл. 5.3).
Таблица 5.3
Последовательность анодных процессов при электролизе
Анод |
Вид аниона |
Процесс, продукты электролиза
|
|
Растворимый (Fe,Ni, Sn Cu, Ag …) |
любой |
Ме 0 ─ n ē → Ме n+ (Fe2+, Ni2+, Sn2+, Cu2+, Ag+, …) |
|
Инертный (C, Pt) |
S 2¯, J¯, Br ¯, Cl ¯
|
Эn− − nē → Э0 S2‾→J‾→ Br‾→ Cl‾ S0, J2, Br2, Cl2 |
|
NO3¯, SO4¯, F ¯
|
кислая среда |
2Н2О − 4ē → О2 + 4Н+ |
|
щелочная среда |
4ОН¯− 4ē → О2 + 2Н2О |
||
