
- •Раздел 5. Окислительно-восстановительные и электрохимические процессы
- •5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
- •Уравнение Нернста
- •Гальванические элементы. Химические источники тока
- •5.2 Электролиз
- •Последовательность электродных процессов
- •Законы электролиза
- •5.3. Коррозия и защита металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Факторы, влияющие на скорость электрохимической коррозии
- •Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •Заключение
Раздел 5. Окислительно-восстановительные и электрохимические процессы
Электрохимическими называются окислительно-восстановительные процессы, протекающие на границе раздела: электрод ─ раствор и сопровождающиеся переносом заряда через эту границу (рис. 5.1).
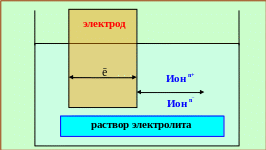
Рис. 5.1 ─ Схема переноса заряда через границу «электрод ─ раствор»
В строительной отрасли значение данных процессов связано, прежде всего, с электрохимической коррозией металлов, которая наносит миллиардные убытки народному хозяйству. Поэтому знание сущности коррозионных процессов и факторов, влияющих на характер и скорость их протекания, имеет большое значение для выбора рациональных методов защиты строительных конструкций от коррозии.
5.1 Электродные потенциалы и гальванический элемент Механизм возникновения электродных потенциалов и определение их величин
Электрод первого рода представляет собой металл, помещённый в водный раствор собственной соли, например: цинк в растворе сульфата цинка или медь в растворе сульфата меди.
Атомы элементов, обладающих металлическими свойствами, содержат мало электронов на внешних электронных уровнях.
Вследствие малой плотности электронов на внешних уровнях атомы металлов в процессе кристаллизации легко сближаются и обобщают электроны, которые приобретают способность легко перемещаться по всему объёму тела. Поэтому в определённый момент времени кристаллическую решётку металла можно представить как состоящую из нейтральных атомов, положительно заряженных ионов и свободных электронов, находящихся в междоузлиях решётки (рис. 5.2).
При контакте металла с раствором собственной соли протекают два противоположных процесса:
а) переход гидратированных ионов металла в раствор;
б) адсорбция катионов из раствора на поверхности металла.
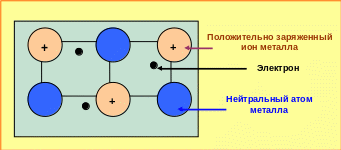
Рис. 5.2 ─ Схема кристаллической решётки металла
В растворе полярные молекулы воды взаимодействуют с поверхностными положительно заряженными ионами металла и «уводят» их в раствор, в результате чего слой раствора, прилегающий к электроду, «заряжается» положительно, а поверхность электрода ─ отрицательно, т.к. в металле остаётся избыток электронов.
Наряду с прямым процессом перехода ионов металла в раствор наблюдается обратный ─ адсорбция ионов металла из раствора соли на поверхности металла:
Me0 + m H2O <══> Me n+∙ m H2O + n e─
При исключении гидратационной воды равновесный процесс на границе «электрод ─ раствор» можно записать следующим образом: Me 0 <══> Me n+ + n e─ .
Если в начальный момент времени скорость первого процесса больше скорости второго, поверхность металла приобретает избыточный отрицательный заряд, а прилегающий слой раствора – положительный; и наоборот, если скорость второго процесса больше скорости первого, поверхность металла заряжается положительно, а прилегающий слой раствора – отрицательно. И в том, и в другом случае между двумя заряженными слоями возникает скачок потенциала (рис. 5.3).
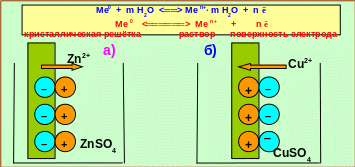
Рис. 5.3 ─ Схема возникновения скачка потенциала на:
а) цинковом (активном) электроде; б) медном (неактивном) электроде
Цинковый электрод в растворе сульфата цинка приобретает отрицательный заряд, т.к. на его поверхности скапливается избыток электронов, когда под действием диполей воды гидратированные ионы металла выходят в раствор. Подобный процесс характерен для активных металлов.
На медном электроде идёт адсорбция ионов меди из раствора на поверхности металла, в результате чего электрод приобретает положительный заряд, что характерно для неактивных металлов.
Таким образом, на границе электрод ─ раствор возникает двойной электрический слой зарядов, или разность потенциалов, измерить абсолютную величину которой не представляется возможным.

В качестве электродов сравнения применяют водородный электрод, потенциал которого в стандартных условиях принят равным нулю, хлоридсеребряный, каломельный и другие электроды, потенциалы которых измеряют по отношению к водородному электроду.
Для определения электродного потенциала собирают электрохимическую цепь, состоящую из исследуемого электрода и электрода сравнения (рис. 5.4), и измеряют электродвижущую силу (ЭДС) цепи.
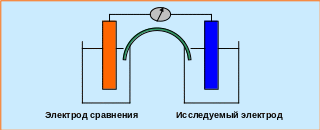
Рис. 5.4 ─ Схема экспериментального определения величины электродного потенциала

