
- •Раздел 1. Строение вещества
- •1.1. Строение атома и периодическая система д.И. Менделеева
- •Квантовая механика
- •Квантовые числа
- •Распределение электронов в атоме
- •Электронные формулы
- •Периодическая система д.И. Менделеева и свойства элементов
- •Атомные радиусы
- •Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •Металличность и неметалличность
- •1.2. Химическая связь
- •Энергия химической связи
- •Длина химической связи
- •Электрический момент диполя и направленность связи
- •Ионная химическая связь
- •Ковалентная химическая связь
- •Метод валентных связей
- •Свойства ковалентной связи
- •Направленность ковалентной связи
- •Кратность химической связи
- •Металлическая связь
Энергия ионизации
Элементы, которые вступая во взаимодействие, отдают электроны на образование химической связи, обладают восстановительными свойствами и мерой их восстановительной способности является потенциал ионизации. Потенциал ионизации – это энергия, которую нужно затратить, чтобы «отнять» электрон от атома. Размерность эВ. эВ рассчитывают на 1 – электрон, если нужно отнять 2 электрона, то затрачивают в два раза больше энергии. Энергия ионизации (измеряется в кДж/моль или эВ) возрастает по периоду. Наименьшее значение энергии ионизации имеют щелочные металлы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода (рис.1.2).
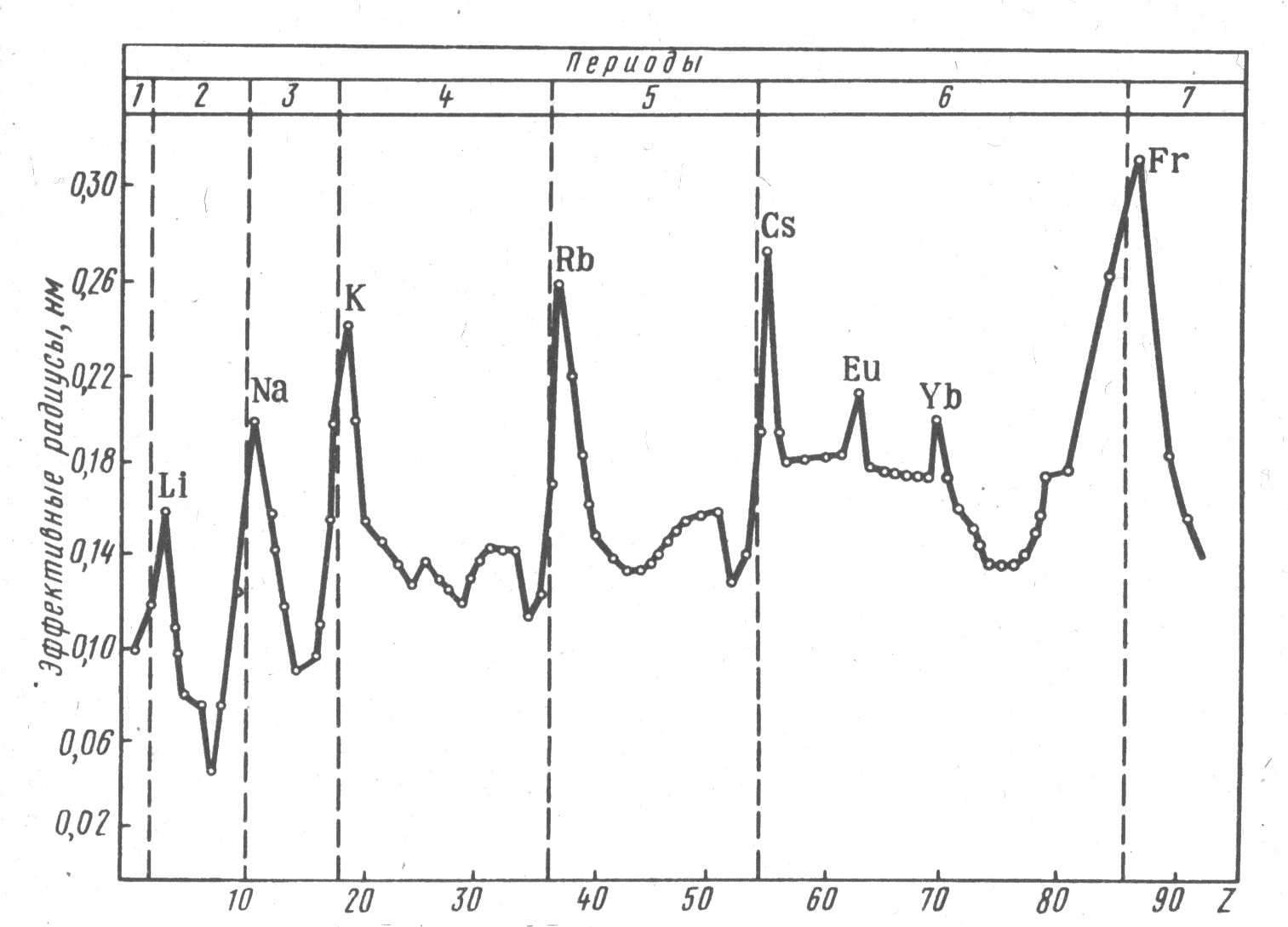
Рис. 1.1. Зависимость эффективных радиусов атомов от порядкового номера элемента

Рис. 1.2. Зависимость ионизационных потенциалов атомов
от порядкового номера элемента
Пики на кривой зависимости энергии ионизации от порядкового номера элемента наблюдаются у элементов с законченной s-подоболочкой (Ве, Мg) и d-подоболочкой (Zn, Cd, Hg) и р-подоболочкой, в АО которой находится по три электрона (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по одному электрону (щелочные металлы, В, Al, Ga, In).
В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атома и расстояния внешних подоболочек от ядра.
Сродство атома к электрону
Элементы, которые, вступая во взаимодействие, оттягивают на себя электроны, обладают окислительными свойствами, и эта способность характеризуется сродством к электрону. Количественной мерой сродства к электрону является энергия, которая выделяется при присоединении электрона к атому, и также измеряется в эВ или кДж/моль.
Сродство к электрону зависит от положения элемента в периодической системе. Наибольшие значения сродства к электрону имеют галогены, кислород, сера, наименьшее элементы с электронной конфигурацией s2 (Не, Ве, Мg, Zn), с полностью или наполовину заполненными р-подоболочками (Ne, Ar, Kr, N, P, As).
В целом, сродство атома к электрону возрастает в периодах от металлов к неметаллам, то есть слева направо, в группах сверху вниз уменьшается.
Электроотрицательность
Для характеристики способности атомов в соединениях притягивать к себе электроны, введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, эта характеристика имеет условный характер. Однако её использование полезно для объяснения типа химических связей и свойств соединений.
Имеется несколько шкал электроотрицательности. Согласно Р. Малликену (США) электроотрицательность равна полусумме энергии ионизации и энергии сродства к электрону. Наименьшие значения ЭО имеют s-элементы 1 подгруппы, наибольшие значения р-элементы 7 и 6 групп.
Как правило, в периоде с увеличением порядкового номера элемента ЭО возрастает, а в группе убывает.
