
- •Раздел 1. Строение вещества
- •1.1. Строение атома и периодическая система д.И. Менделеева
- •Квантовая механика
- •Квантовые числа
- •Распределение электронов в атоме
- •Электронные формулы
- •Периодическая система д.И. Менделеева и свойства элементов
- •Атомные радиусы
- •Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •Металличность и неметалличность
- •1.2. Химическая связь
- •Энергия химической связи
- •Длина химической связи
- •Электрический момент диполя и направленность связи
- •Ионная химическая связь
- •Ковалентная химическая связь
- •Метод валентных связей
- •Свойства ковалентной связи
- •Направленность ковалентной связи
- •Кратность химической связи
- •Металлическая связь
Распределение электронов в атоме
От распределения электронов в атоме зависят химические свойства элементов. По электронным формулам можно определить свойства элемента. Распределяются электроны в атоме согласно четырем принципам:
∙ принцип наименьшей энергии;
∙ правило Клечковского;
∙ принцип Паули;
∙ правило Гунда.
Принцип наименьшей энергии. Любая система, в том числе и микрочастицы, в том числе и электроны, стремятся занять положение, более энергетически выгодное, т.е. с наименьшей энергией. Сначала заполняется 1-й энергетический уровень, затем 2-й энергетический уровень и т.д.
Правило Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме n + l в порядке возрастания числа n. Соответственно этому правилу подоболочки выстраиваются в следующий ряд:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d …
Принцип Паули гласит, что в атоме не может быть двух одинаковых электронов, со всеми одинаковыми четырьмя квантовыми числами, хотя бы одним квантовым числом они должны отличаться.
Правило Гунда. Электроны на эквивалентных орбиталях располагаются так, чтобы суммарный спин их был максимальный. Орбиталь обозначаем , а спин электрона: (+1/2), (-1/2).
n = 1, l = 0 S, ml = 0, ms = +1/2, -1/2. 2ē
n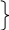 = 2, l = 0
S, ml
= 0, ms
= +1/2, -1/2. 2ē
= 2, l = 0
S, ml
= 0, ms
= +1/2, -1/2. 2ē
8ē
l = 1 P, ml = -1, 0, +1, ms = +1/2, -1/2. 6ē
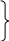
n = 3, l = 0 S, ml = 0, ms = +1/2, -1/2. 2ē
l = 1 P, ml = -1, 0, +1, ms = +1/2, -1/2. 6ē
18ē
l = 2 d, ml = -2, -1, 0, 1, 2, ms = +1/2, -1/2. 10ē
n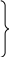 = 4, l = 0
S, ml
= 0, ms
= +1/2, -1/2. 2ē
= 4, l = 0
S, ml
= 0, ms
= +1/2, -1/2. 2ē
l = 1 P, ml = -1, 0, +1, ms = +1/2, -1/2. 6ē
32ē
l = 2 d, ml = -2, -1, 0, 1, 2, ms = +1/2, -1/2. 10ē
l = 3 f, ml = -3, -2, -1, 0, 1, 2, 3, ms = +1/2, -1/2. 14ē
Количество электронов на данном уровне можно определить по формуле 2 n2, но эта формула справедлива только до 4-го энергетического уровня, на остальных уровнях больше 32 ē быть не может.
Электронные формулы
Номер периода показывает число энергетических слоев, которые у атома заполняются электронами. Номер элемента – это число электронов у данного атома. Номер группы – это число валентных электронов находящихся у атома, т.е. число электронов, которыми атом может вступать в химическую связь.
В малых периодах: 1, 2, 3-ем заполняются s- и p-орбитали последнего уровня.
Na11 1s2 2s2 2p6 3s1
Cl17 1s2 2s2 2p6 3s2 3p5 3d0
Ca20 1s2 2s2 2p6 3s2 3p6 4s2 3d0 4p0
В больших периодах, начиная с 4-го, после s-орбитали последнего уровня заполняется d орбиталь предыдущего, а затем p-орбиталь последнего.
Br35 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
4-ый f -уровень заполняется у лантаноидов и 5 f − у актиноидов.
