
- •Раздел 1. Строение вещества
- •1.1. Строение атома и периодическая система д.И. Менделеева
- •Квантовая механика
- •Квантовые числа
- •Распределение электронов в атоме
- •Электронные формулы
- •Периодическая система д.И. Менделеева и свойства элементов
- •Атомные радиусы
- •Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •Металличность и неметалличность
- •1.2. Химическая связь
- •Энергия химической связи
- •Длина химической связи
- •Электрический момент диполя и направленность связи
- •Ионная химическая связь
- •Ковалентная химическая связь
- •Метод валентных связей
- •Свойства ковалентной связи
- •Направленность ковалентной связи
- •Кратность химической связи
- •Металлическая связь
Кратность химической связи
Кратные связи — это ковалентные связи, образуемые более чем одной парой электронов. В молекуле этилена С2Н4 каждый из возбужденных атомов углерода подвержен sp2-гибридизации. Две гибридные орбитали используются на образование связи с двумя атомами водорода, а третья гибридная орбиталь для связи с другим атомом углерода. Таким образом, у каждого атома углерода в запасе остается еще по одному неспаренному 2р-электрону. При sp2-гибридизации электронные облака располагаются в одной плоскости под углами 120° друг относительно друга. Из экспериментальных данных действительно следует, что молекула этилена имеет плоское строение.
Химическая связь, для которой линия, соединяющая атомные ядра, является осью симметрии связывающею электронною облака, называется -связью. -связь возникает при "лобовом" перекрывании атомных орбиталей. В молекуле этилена каждый атом углерода образует по три -связи: одну — друг с другом, а две другие — с двумя атомами водорода. Имеющиеся у атомов углерода негибридные орбитали образуют одну так называемую -связь. Химическая связь, для которой связывающее электронное облако имеет только плоскость симметрии, проходящую через атомные ядра, называется -связью. На рис. 1.10. -связь показана пунктиром. В действительности при образовании -связей происходит "боковое" перекрывание атомных орбиталей (рис. 1.10).
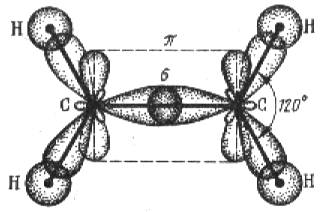
Рис. 1.10. Строение молекулы этилена
Таким образом, две связи между атомами углерода в этилене неравноценны: одна из них — -связь, а другая -связь. Перекрывание электронных облаков при образовании -связи меньше. Кроме того, области перекрывания лежат дальше от ядер, чем при образовании -связи. Вследствие этих причин -связь обладает меньшей прочностью по сравнению с -связью. Поэтому энергия двойной связи меньше удвоенной энергии одинарной связи, которая всегда является -связью.
Приведенные примеры дают основание утверждать, что одинарная связь всегда является чистой или гибридной -связью. Двойная связь состоит из одной - и одной -связи.
Наконец, тройная связь слагается из одной - и двух -связей, расположенных перпендикулярно друг другу. Примером может являться молекула ацетилена (С2Н2) или азота, центральный атом подвергается sp – гибридизации, валентный угол в этой молекуле 180°, строение – линейное (рис. 1.11).
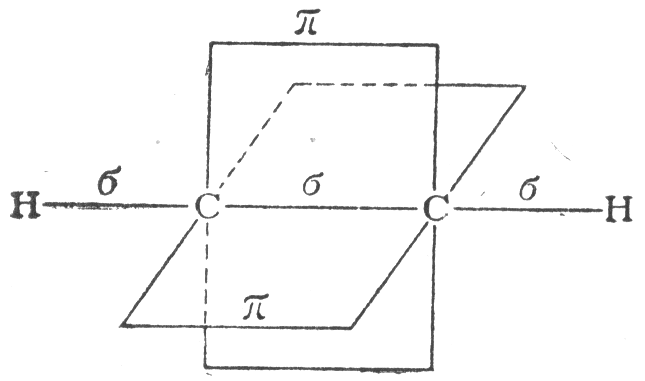
Рис. 1.11. Строение молекулы ацетилена
Металлическая связь
Металлы отличаются от других веществ высокими значениями электро- и теплопроводности, а их структуры характеризуются высокими координационными числами. О существовании межатомной связи в металлах свидетельствуют энергии атомизации металлов, которые меняются в широких пределах. Между ковалентной и металлической связями имеется большое сходство — оба типа химической связи основаны на обобществлении валентных электронов. Только в металлах обобществленные электроны обслуживают весь кристалл, т.е. они полностью делокализованы. Этим объясняются отсутствие пространственной направленности металлической связи и высокие координационные числа металлических структур. Это означает, что металлическая связь не проявляет свойств насыщаемости, столь характерных для ковалентной связи. Делокализация же валентных электронов в металлах янляется следствием многоцентрового характера металлической связи. Многоцентровость металлической связи обеспечивает высокую электрическую проводимость и теплопроводность металлов.
Металлический связь — многоцентровая химическая связь с дефицитам электронов в твердом или жидком веществе, основанная на обобществлении внешних электронов атомов. Таким образом, металлическая связь характерна только для конденсированного состояния вещества.
Металлическая связь в чистом виде характерна только для щелочных и щелочноземельных металлов Согласно теории свободных электронов в узлах решетки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределенный по всему металлу. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов.
Основная литература:
1. Коровин Н.В. Общая химия. М.: Высшая школа, 2008. – 557 с. §§ 1.1– 1.5, 2.1–2.5
2. Глинка Н.Л. Общая химия. Л.: Химия, 1983. – 704 с. Глава II – IV.
