
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Энергия активации каталитических реакций
Основная причина, позволяющая катализаторам увеличивать скорость реакции, заключается в том, что катализатор создает новый путь протекания реакции, характеризующийся другим значением энергии активации.
Катализаторы, снижая величину энергии активации Еa увеличивают число активных частиц, способных принять участие в реакции и, тем самым, увеличивают скорость химической реакции. Например, снижение энергии активации всего на 5 кДж приводит к увеличению скорости в 10 раз.
Связь между энергией активации Еа и тепловым эффектом реакции ΔН (или энергией разрыва отдельной связи в этой реакции) описывается эмпирическим соотношением Бренстеда-Поляни (соотношение линейности):
![]()
Е0 и α – постоянные коэффициенты в ряду сходных катализаторов для данной реакции или в ряду однотипных реакций для данного катализатора. Е0 относится к реакции, α – к катализатору.
Для двух однотипных катализаторов для данной реакции изменение энергии активации пропорционально изменению теплового эффекта:
![]()
Зависимость констант скоростей элементарных стадий каталитических реакций от температуры описывается уравнением Аррениуса. Энергии активации элементарных стадий называют истинными, а найденные по температурной зависимости эффективной константы – эффективными.
Соотношение между эффективной и истинной энергиями активации
Для примера рассмотрим каталитическую реакцию, протекающую по слитному механизму. Условия: система закрытая, V = const, реакции элементарные мономолекулярные, реакция (1) – обратимая, реакция (2) – не обратимая; подходит уравнение 1-го порядка.
![]()
Величина эффективной энергии активации зависит от соотношения констант скоростей реакции.
Если лимитирующей
является первая стадия (![]() ),
),![]() является
истинной.
является
истинной.
![]() .
.
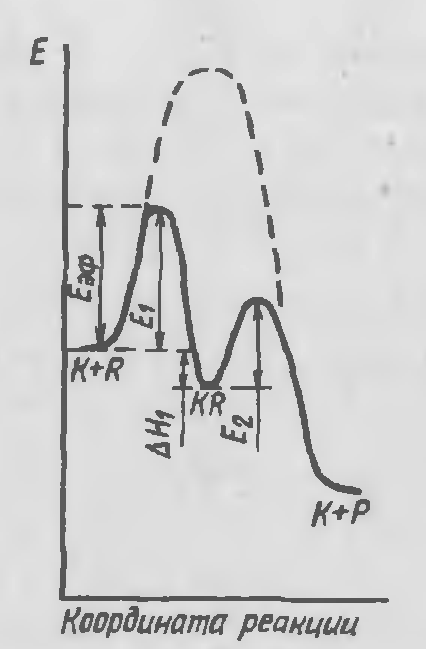
Профиль поверхности потенциальной энергии реакции для двухстадийной каталитической реакции. Лимитирующая стадия – образование комплекса с катализатором
Если лимитирующей является вторая стадия, то на первой стадии устанавливается равновесие. включает наряду с энергией активации и тепловые эффекты равновесных стадий. В этом случае в зависимости от величины теплового эффекта может быть как меньше, так и больше истинной энергии активации.
![]() ,
,
где
![]() – тепловой эффект первой равновесной
стадии.
– тепловой эффект первой равновесной
стадии.
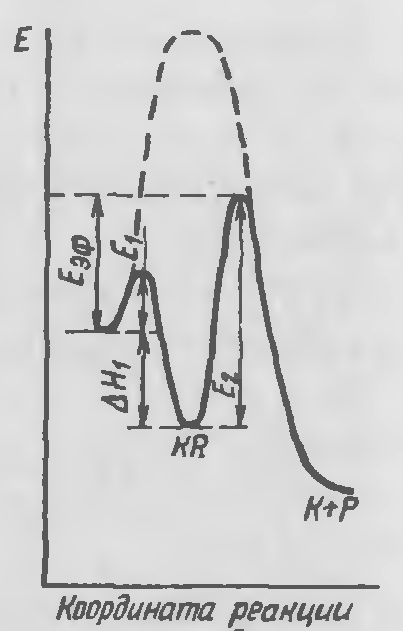
Профиль поверхности потенциальной энергии реакции для двухстадийной каталитической реакции. Лимитирующая стадия – образование продуктов реакции.
Эффективная энергия активации может зависеть от температуры.
Специфичность катализа
Специфичность каталитического действия заключается в том, что реакции данного типа ускоряются катализаторами определенного химического состава независимо от того, являются они гомо- или гетерогенными:
= кислотно-основные реакции ускоряются кислотами;
= окислительно-восстановительные – переходными металлами и их соединениями, при этом особенно высоким каталитическим действием обладают металлы группы 8B.
Специфичность свойственная в той или иной мере всем катализаторам и обусловлена типом химической связи (ковалентной, координационной, водородной, ….), которая возникает при взаимодействии реагента с катализатором.
В образовании химической связи с реагентом участвуют только определенные группы атомов катализатора. Такую группу атомов называют каталитическим центром или активным центром. Строение и структура активного центра определяет специфичность катализатора.
