
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Определение лимитирующей стадии (реакция или диффузия?)
При повышении температуры лимитирующая стадия и соответственно механизм гетерогенного процесса могут меняться. Это связано с разным характером зависимости константы скорости реакции и коэффициента массопереноса от температуры.
![]() и
и
![]()
![]() и
и
![]()
(ν – показатель степени, с которым коэффициент диффузии и константа скорости входят в соответствующие уравнения скорости процесса)
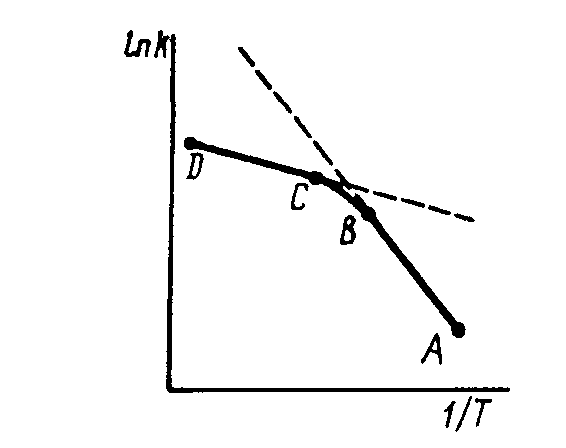
Влияние температуры на константу скорости гетерогенного процесса. AB – кинетическая область, CD – диффузионная область, DC – промежуточная область.
При повышении температуры константа скорости химического процесса быстро увеличивается и, начиная с некоторой температуры, k > β, - константа скорости процесса больше коэффициента массопередачи и лимитирующей стадией становится диффузия. Переход из кинетической области в диффузионную происходит постепенно. При этом наблюдается изменение углового коэффициента на графике зависимости константы скорости от температуры.
По величине углового коэффициента (т.е. по энергии активации) и судят о природе лимитирующей стадии.
Если энергия активации 5 – 20 кДж/моль, то процесс диффузионный.
Если энергия активации 50 – 200 кДж/моль, то процесс кинетический.
Электролиз
Электролиз – это окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока в расплаве или растворе электролита. Электрод, на котором протекает процесс восстановления, называется катодом, а электрод, на котором протекает процесс окисления, называется анодом. При рассмотрении катодных процессов материал электрода не имеет значения. Аноды могут быть двух типов. Активный или растворимый анод изготовляется из неблагородного металла, и, как правило, сам окисляется:
![]()
Если материал анода не принимает участие в электродной реакции, то он называется инертным. Это могут быть угольные или платиновые электроды.
Электролиз – это сложный комплекс одновременно протекающих химических и электродных реакций.
Простейший случай – это электролиз с угольными электродами водных растворов сильных электролитов. В этих случаях характер электродных процессов зависит только от природы ионов, на которые диссоциируют электролиты.
Порядок восстановления катионов
Если стандартный
потенциал металла
![]()
На катоде восстанавливаются только ионы водорода молекул воды.
Уравнение катодного процесса:
![]()
Если стандартный
потенциал металла
![]() ,
то на катоде одновременно протекают
процессы:
,
то на катоде одновременно протекают
процессы:
![]()
Если стандартный
потенциал металла
![]() ,
то на катоде восстанавливаются только
ионы металла:
,
то на катоде восстанавливаются только
ионы металла:
![]() .
.
При электролизе сильных кислот уравнение катодного процесса имеет вид:
![]()
Порядок окисления анионов
При электролизе растворов бескислородных кислот и их солей анионы и их солей: галогенид-ионы – Cl‒, Br‒, I‒ (кроме F‒) и сульфид ион S2 окисляются по схеме:
![]()

![]()
При электролизе растворов оснований гидроксид-ионы окисляются по схеме:
![]()
При электролизе растворов, высших кислородных кислот и растворов содержащих фторид-ионы, уравнение анодного процесса имеет вид:
![]()
Кинетика электродных процессов (поляризация и перенапряжение)
При электролизе и эксплуатации химических источников тока через электрохимические системы протекает электрический ток. При этом равновесное состояние
Ох + ze = Red,
существующее на электроде в отсутствие внешнего тока, нарушается. В зависимости от направления тока электродная реакция может протекать:
в катодном направлении
Ох + ze = Red
в анодном направлении
Red = Ох + ze
Мерой скорости электрохимической реакции является плотность тока − сила тока, отнесенная к единице площади поверхности электрода:
![]() .
.
Электродное равновесие Ох + ze = Red является динамическим, при котором скорость реакции в катодном (jк) и анодном (jа) направлениях одинаковы:
jк = jа = j0,
где j0 – плотность тока обмена. Она является мерой скорости обменного процесса в условиях равновесия и зависит от природы реакции и концентрации участвующих в ней веществ.
Для осуществления электролиза необходимо подать напряжение
Uэ = a − к + U,
где a и к – потенциалы анода и катода при рабочей плотности тока; U – падение напряжения на сопротивление электролита, электродов, контактов…
Электродные потенциалы представляют собой индивидуальные характеристики электрохимических реакций и зависят от условий их протекания. Разность потенциалов анода и катода называется напряжением разложения электролита:
![]()
Величины потенциалов катода и анода определяются уравнениями:
Потенциал анода:
![]()
Потенциал катода
![]()
![]() и
и
![]() – равновесные потенциалы, а
и к,
– перенапряжение анодной и катодной
реакций
– равновесные потенциалы, а
и к,
– перенапряжение анодной и катодной
реакций
![]()
Разность равновесных потенциалов электродных реакций называется обратимым напряжением разложения электролита U0 и численно равно ЭДС электрохимической цепи, в которой протекает реакция, обратная реакции при электролизе.
Величины U0 и U' электролитов можно определить с помощью экспериментально полученных поляризационных кривых. U0, кроме того, можно вычислить по уравнению Нернста, как разность потенциалов.
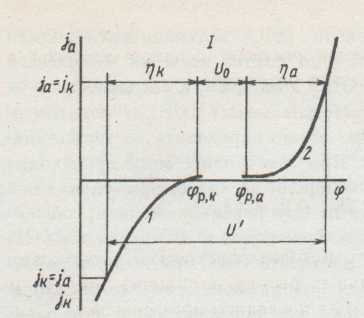
Поляризационная кривая
