
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Последовательные реакции первого порядка
Рассмотрим реакцию, состоящую из двух последовательных стадий первого порядка:
![]()
Для вывода уравнений зависимости степени превращения веществ от времени потребуется составить материальный баланс:
-
А
B
D
Реакция 1: А = В
Реакция 2: В = D
t = 0
СA,0
CB,0
СA,0
CD,0
t > 0
‒x
+x
‒y
+y
Ct
CA,0 ‒ x
CB,0 + x ‒ y
CD,0+y
Скорость первой реакции (считая ее протекающей по первому порядку):
![]() .
.
Скорость образования продукта реакции:
![]()
или
![]()
Решение этого дифференциального уравнения дает:
![]() ;
;
![]()
![]()
т.е. на кинетической
кривой
![]() для промежуточного вещества В должен
быть максимум. Координаты этого максимума
(
для промежуточного вещества В должен
быть максимум. Координаты этого максимума
(![]() )
определяются из условия
)
определяются из условия
![]() .
.
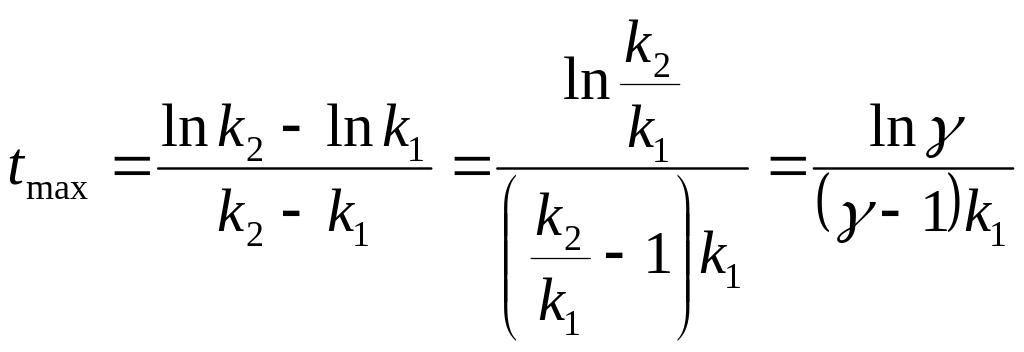 ,
,
Времени tmax отвечает максимальная концентрация промежуточного вещества В:
![]()
![]()
При
![]() ,
,
![]() ,
т.е. медленной первой стадии
,
т.е. медленной первой стадии
![]() ;
;
при
![]() ,
,
![]() ,
т.е. медленной второй стадии
,
т.е. медленной второй стадии
![]() ;
;
при
![]() ,
,
![]() .
.
Уравнения для констант скоростей реакций отвечают стандартным уравнениям первого порядка:
![]()
![]()
Сопряженные реакции
По определению Н.А. Шилова, при протекании сопряженных процессов самопроизвольно идущая в системе реакция вызывает протекание другой реакции, не осуществимой в отсутствие первой. Две реакции, одна из которых индуктирует протекание другой, называются сопряженными.
Сопряженную реакцию можно представить в виде схемы:
Вещество А, реагируя
с веществом В, дает вещество М:
![]() .
.
Вещество А без
вещества В с веществом С не взаимодействует:
![]() .
.
При взаимодействии
А, В и С образуются вещества М и N:
![]() .
.
Вещество А, которое участвует в обеих реакциях, называется актором. Вещество В, реагирующее с веществом А (актором) и индуцирующее реакцию А и С, называется индуктором. Вещество С, взаимодействие которого с актором возможно только при наличии химический индукции, называется акцептором.
Количественная характеристика эффективности химической индукции называется фактором индукции:
![]()
Фактор индукции равен отношению скорости расходования акцептора к скорости расходования индуктора.
Сопряженные реакции осуществляются в том случае, если промежуточные вещества первой стадии служат исходными для последующей стадии, вступая во взаимодействие с акцептором.
В сопряженных химических реакциях энергия Гиббса, выделяемая при самопроизвольном процессе, в котором участвует актор, расходуется для протекания второй реакции, протекание которой сопровождается увеличением энергии Гиббса и без сопряженной реакции невозможна.
Автокаталитические реакции
Реакция называется автокаталитической, если она ускоряется одним из продуктов реакции. При автокатализе концентрация катализатора увеличивается, следовательно, автокаталитические реакции к классическим случаям катализа (признак – постоянство концентрации катализатора) не относятся.
Зависимость скорости автокаталитической реакции от концентрации, времени и т.п. завися от условий ее проведения.
Для закрытых систем общим является наличие максимума на зависимости скорости реакции от концентрации катализатора или времени и наличие индукционного периода, если начальная концентрация продукта-катализатора мала.
Для закрытых систем основными стадиями автокаталитической реакции являются:
![]() ‒ лимитирующая
стадия;
‒ лимитирующая
стадия;
![]() ‒ быстрая стадия;
‒ быстрая стадия;
![]() ‒ суммарная
реакция.
‒ суммарная
реакция.
А – исходное вещество, В – промежуточное соединение; В – продукт реакции, который является катализатором.
Начальная скорость автокаталитической реакции при t = 0, СA = CA,0, CB = CB,0;
![]()
При дальнейшем развитии процесса t > 0 скорость его увеличивается
![]()
и достигает максимального значения
![]()
при концентрации
продукта-катализатора
![]() ,
которая соответствует времени
полупревращения исходного вещества А:
,
которая соответствует времени
полупревращения исходного вещества А:
![]()
При t = ∞ (состояние равновесия) СА = 0, CB = CA,0.

Зависимость скорости автокаталитической реакции от концентрации продукта-катализатора
Если концентрация продукта-катализатора В в начальный период времени мала, то реакция вначале практически не протекает. Этот период времени называют периодом индукции. Он характерен для автокаталитических реакций в закрытой системе. Определение продолжительности периода индукции связано с возможностями анализа. Когда продукт-катализатор можно обнаружить в системе – конец периода индукции.
