
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Историческая справка о науке электрохимии
Возникновение электрохимии как науки относится к рубежу XVIII и XIX вв. и связано с работами Л.Гальвани, А.Вольта, В.В.Петрова, Г.Дэви. 1833 г. М.Фарадей – законы электролиза; 1887 г. С.Аррениус – положения теории электролитический диссоциации; 1890 г. Нернст – теория возникновения электродного потенциала. XX в – теория растворов электролитов (П.Дебай + Э.Хюккель + Л.Онзагер), теория двойного электрического слоя (Ж.Гуи, Д.Чапмен, О.Штерн, А.Фрумкин), электрохимическая кинетика (А.Фрумкин + Фольмер).
Растворы электролитов Основные понятия и определения
Электролитами называются вещества, которые в растворе или в расплаве самопроизвольно (частично или полностью) распадаются на ионы. Ион – заряженная частица, способная к самостоятельному существованию. Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита.
Раствором электролита называется неметаллическая жидкая смесь, способная переносить электрический заряд.
Для раствора электролита соблюдается правило электронейтральности. В соответствии с правилом электронейтральности, сумма положительных зарядов равна сумме отрицательных зарядов.
В кристаллах с ионной связью ионы располагаются в узлах кристаллической решетки. Например, кристаллы хлорида натрия NaCl состоят из ионов Na+ и Cl−. При попадании кристалла хлористого натрия в воду ионы натрия и хлора переходят в раствор в результате их взаимодействия с молекулами воды. В растворе получаются гидратированные ионы
.

Схема ориентации молекул воды в электростатическом поле, создаваемом ионами хлорида натрия.
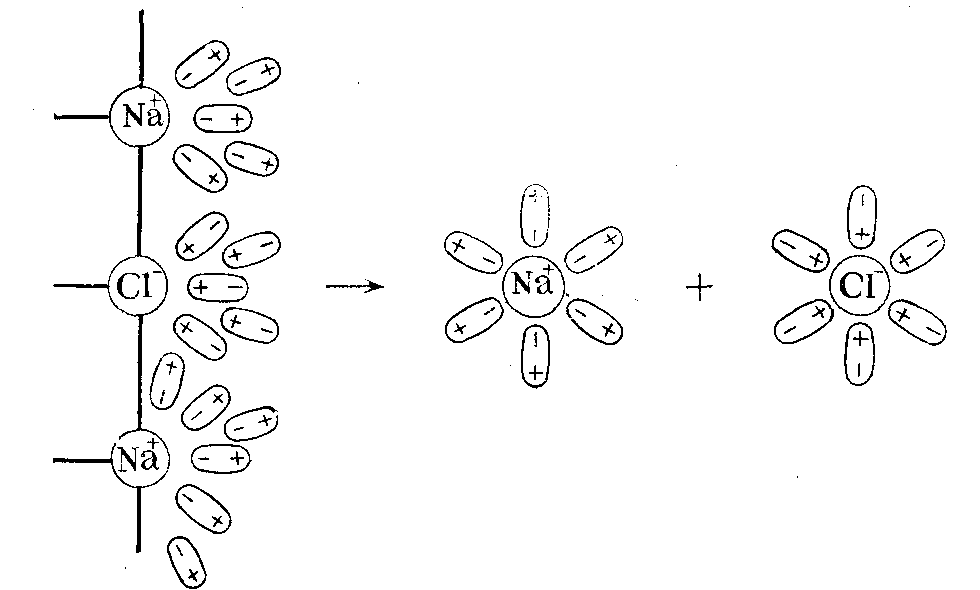
Схема отрыва ионов натрия и хлора от кристалла хлорида натрия и гидратации этих ионов.
При растворении полярных веществ в растворителях, имеющих высокую диэлектрическую проницаемость (растворителях полярных), происходит ослабление и разрыв связей между атомами в молекулах растворяемого вещества, что приводит к образованию ионов. Например, при растворении в воде соляной кислоты под действием молекул воды происходит диссоциация полярных молекул HCl на ионы и гидратация их в растворе.

Схема гидратации и деформации молекул с полярной связью.

Схема электролитической диссоциации молекул с полярной связью.
Историческая справка о природе растворов электролитов
Первые представления о переносе электрического заряда в растворах были высказаны в трудах Гроттуса (1805 г.). Основная идея – эстафетный перенос заряда от одной молекулы воды к другой под действием приложенной разности потенциалов. Молекула воды при контакте с электродом теряет заряд – в зависимости от знака заряда электрода «плюс» или «минус». Далее этот заряд передается как бы по эстафете от молекулы к молекуле.
Продолжение теория Гроттуса получила в ионных теориях электропроводности Фарадея (1833 г.) и Клаузиуса (1857 г.). Клаузиус, в частности показал, что выполнение закона Ома для растворов электролитов даже при самых низких напряжениях на измерительных электродах свидетельствует о постоянно существующих переносчиках заряда в растворе электролита.
Вант-Гофф попытался распространить теорию идеальных растворов на растворы электролитов. Для этого он ввел в уравнение осмотического давления коэффициент i (осмотический коэффициент В-Г), физический смысл которого долгое время оставался неясным.
Коэффициент В-Г был введен и в другие уравнения, описывающие свойства идеальных растворов с целью сделать их пригодными к применению для растворов электролитов (1877 г., Планк, 1-й номер ЖФХ).
Там же и тогда же. Аррениус предложил, что при растворении веществ в растворителе происходит их частичное разложение (диссоциация), результатом которого является появление в растворе заряженных частиц или ионов. Аррениус ввел понятие степени диссоциации, которое является мерой диссоциации, и которое он отождествлял с понятием коэффициент активности. Авторское определение: «отношение числа ионов, действительно существующих в растворе электролита, к числу ионов, которое получилось бы при полном распадении электролита на простые электростатические молекулы».
Предположения Клаузиуса, Вант-Гоффа, Планка и Аррениуса считаются основой современной теории электролитической диссоциации, которая определяется собственно двумя положениями:
= гипотезой электролитической диссоциации Аррениуса и
= связью степени диссоциации с концентрацией электролита в растворе через закон действия масс (закон разведения Оствальда):
![]()
Сразу после опубликования теория Аррениуса вызвала ряд возражений. В числе именитых противников – Менделеев, Коновалов, Бекетов и др.
Менделеев: не все реакции в растворах идут с участием ионов; они могут быть реализованы при взаимодействии нейтральных молекул, например, хлористые соли могут образовываться из растворов, где соляная кислота диссоциирована (водные среды) и не диссоциирована (бензольные растворы). Многие электролиты поглощают свет пропорционально их концентрации, хотя по теории Аррениуса такой пропорциональности быть не может. Менделеев сомневался, могут ли в растворе возникать такие силы, которые вызывают разложение таких прочных соединений, как хлориды натрия или калия.
Коновалов: причиной электропроводности растворов электролитов является не диссоциация, а наоборот, ассоциация.
Еще к недостаткам теории Аррениуса. В некоторых системах молекулы растворенного вещества не диссоциируют на катионы и анионы, а ионизируются, т.е. распадаются на катион и «свободный» электрон. Пример – растворы некоторых металлов (щелочных, щелочноземельных, редкоземельных) в жидком аммиаке. Электропроводность подобных растворов с ростом концентрации увеличивается почти экспоненциально!
Компромиссом между различными взглядами на теорию растворов электролитов стало разделение электролитов на сильные и слабые. Слабые электролиты подчиняются теории Аррениуса, сильные – практически нет. Полностью же увязать в единую теорию все взгляды прошлого и современности на процессы в растворах электролитов по-прежнему не удается.
