
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
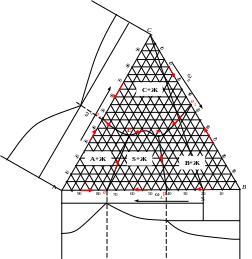
Точки двойных эвтектик е1, е2, и е3 на диаграмме показывают составы жидких фаз, насыщенных двумя твердыми фазами, соответственно А и С, В и С, А и S, из которых при постоянных температурах эти фазы кристаллизуются.
На диаграмме имеются пять граничных линий, направление падения температуры на которых определено по правилу Алькемаде и указано стрелками.
Рассмотрим процессы, протекающие на каждой из них. На линиях двойных эвтектик е1Е, е2Е е3Р и РЕ происходит кристаллизация пограничных хозяев полей:
е1Е: А + S = Ж;
е2Е: A + C = Ж;
е3Р: В + С = Ж;
РЕ: С + S = Ж.
Пятая линия рР называется реакционной. Как и перитектическая точка р в бинарной системе АВ, показывающая состав жидкости, способной реагировать с компонентом С, образуя химическое соединение S по реакции Жр + С = S, реакционная линия показывает изменение состава перитектической жидкости в ходе той же самой реакции Жр + С = S. Так как в равновесии при этом находятся три фазы, у системы остается одна степень свободы и температура при протекании этой реакции может меняться. Направление падения температуры на реакционной линии принято показывать двойной стрелкой.
Точка Р диаграммы называется реакционной, так как при температуре, отвечающей точке Тр, протекает фазовая реакция ЖР + С = S + В. Безвариантное состояние системы (F = 3 + 1 ‒ 4 = 0) продолжается до тех пор, пока при изотермическом охлаждении системы число фаз не уменьшится.
Пути кристаллизации и кривые охлаждения различных точек системы
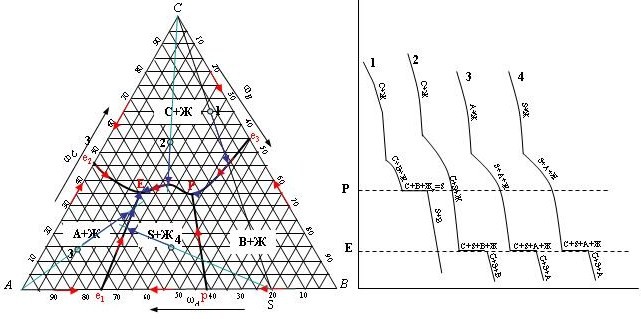
Точка 1. Если исходный состав сплавов находится на соединительной прямой BS, то в точке Р в реакции участвуют эквивалентные массы перитектической жидкости и кристаллов компонента С. В результате при температуре Тр (точка Р) обе эти фазы исчезают, кристаллизация заканчивается и остаются две фазы: кристаллы S и В.
Точки 2 и 3. Кристаллизация заканчивается в точке тройной эвтектики Е. Направление луча – от соответствующего «хозяина поля» к рассматриваемой фигуративной точке.
Точка 4. Находится в поле, где «хозяином» является соединение S. Соответственно, направляющий луч идет от точки двойного соединения S к точке 4. Все точки поля «S» кристаллизуются в точке тройной эвтектики.
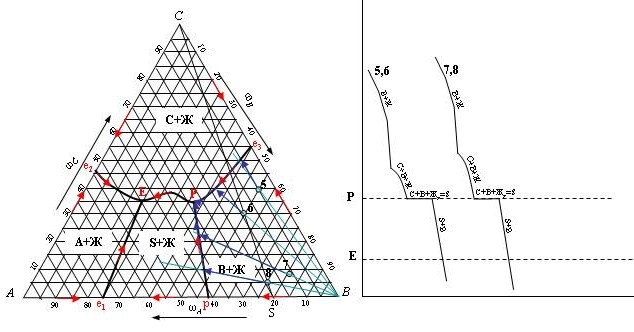
Если исходный состав сплавов располагается в треугольнике SBC, кристаллизация их заканчивается также при температуре Тр, так как в этом случае при избытке кристаллов компонента С в результате реакции исчезает жидкая фаза и остаются три твердые фазы: S, В и С.
Точка 5. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. На линии двойной эвтектики «е3Р» происходит кристаллизация компонентов В и С. Вещество S здесь выделяться не может, т.к. не является хозяином поля и линия «е3Р» не является линией перитектики. В точке Р начинается кристаллизация вещества S. Прекращается кристаллизация компонента В, который начинает расходоваться на образование S по реакции: А + В = S. Окончательно в точке Р: S, C, ЖР и остаток В, который находится в избытке по отношению к составу вещества S. Состав твердой фазы после окончания процесса кристаллизации: S, C, и остаток В
Точка 6. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. На линии двойной эвтектики «е3Р» происходит кристаллизация компонентов В и С. Вещество S здесь выделяться не может, т.к. не является хозяином поля и линия «е3Р» не является линией перитектики. В точке Р начинается кристаллизация вещества S. Прекращается кристаллизация компонента В, который начинает расходоваться на образование S по реакции: А + В = S. Точка 6 находится на линии состава S, следовательно, вещество В в системе присутствует точно в стехиометрическом количестве для образования S. Состав твердой фазы после окончания процесса кристаллизации: S, и C.
Точка 7. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. Далее, при кристаллизации по линии перитектики рР, начинается и развивается образование вещества S, которое одновременно кристаллизуется. Дополнительный ориентир: линия рР граничит с полем, где S является «хозяином». Процесс заканчивается в точке тройной перитектики Р: S, C, ЖР и остаток В, который находится в избытке по отношению к составу вещества S. Состав твердой фазы после окончания процесса кристаллизации: S, C, и остаток В.
Точка 8. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. Далее, при кристаллизации по линии перитектики рР, начинается и развивается образование вещества S, которое одновременно кристаллизуется. Дополнительный ориентир: линия рР граничит с полем, где S является «хозяином». Процесс заканчивается в точке тройной перитектики Р. Точка 6 находится на линии состава S, следовательно, вещество В в системе присутствует точно в стехиометрическом количестве для образования S. Состав твердой фазы после окончания процесса кристаллизации: S, и C.
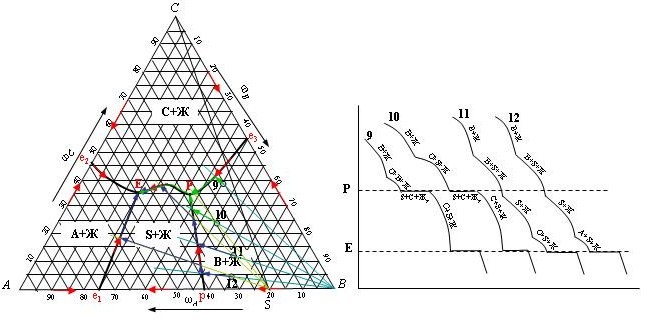
Общим для рассмотрения процессов кристаллизации точек 9 – 12 является недостаток компонента В по отношению к составу вещества S и компоненту А.
Точка 9. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. На линии двойной эвтектики «е3Р» происходит кристаллизация компонентов В и С. Вещество S здесь выделяться не может, т.к. не является хозяином поля и линия «е3Р» не является линией перитектики. В точке Р происходит образование вещества S, которое сопровождается расходованием и растворением компонента В. В точке Р: S, C и Ж, содержащая избыток компонента А. Дальнейший ход кристаллизации приведет в точку тройной эвтектики Е. По линии РЕ будет идти кристаллизация S и С. В точке Е начнется осаждение компонента А. Состав твердой фазы после окончания процесса кристаллизации: A, S, C.
Точка 10. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. Далее, при кристаллизации по линии перитектики рР, начинается и развивается образование вещества S, которое одновременно кристаллизуется. В точке Р продолжается образование вещества S, которое сопровождается расходованием и растворением компонента В: S, C и Ж, содержащая избыток компонента А. Дальнейший ход кристаллизации приведет в точку тройной эвтектики Е. По линии РЕ будет идти кристаллизация S и С. В точке Е начнется осаждение компонента А. Состав твердой фазы после окончания процесса кристаллизации: A, S, C.
Точка 11. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. Далее, при кристаллизации по линии перитектики рР, начинается и развивается образование вещества S, которое одновременно кристаллизуется. Компонент В при этом плавится и расходуется на образование S. Компонент В заканчивается раньше, чем система придет в точку Р. В системе остаются A, S и C. Направляющая от В явно указывает на ход кристаллизации через поле «S». Следовательно, требуется провести еще одну направляющую через точку – от хозяина «S». Далее путь кристаллизации пойдет по направляющей от S до линии РЕ, где будет продолжаться кристаллизация S и начнется кристаллизация С. В точке тройной эвтектики Е будет продолжаться кристаллизация С и S и начнется кристаллизация компонента А. Состав в Е: S, A и ЖЕ. Состав твердой фазы после окончания процесса кристаллизации: A, S, C.
Точка 12. При охлаждении системы по направляющей от «В» происходит выделение кристаллов компонента В. Далее, при кристаллизации по линии перитектики рР, начинается и развивается образование вещества S, которое одновременно кристаллизуется. Компонент В при этом плавится и расходуется на образование S. Компонент В заканчивается раньше, чем система придет в точку Р. В системе остаются A, S и C. Направляющая от В явно указывает на ход кристаллизации через поле «S». Следовательно, требуется провести еще одну направляющую через точку – от хозяина «S». Далее путь кристаллизации пойдет по направляющей от S до линии е1Е, где будет продолжаться кристаллизация S и начнется кристаллизация А. В точке тройной эвтектики Е будет продолжаться кристаллизация А и S и начнется кристаллизация компонента С. Состав в Е: S, A и ЖЕ. Состав твердой фазы после окончания процесса кристаллизации: A, S, C.
