
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Правило луча
Другим важным свойством концентрационного треугольника является «правило луча», в соответствии с которым любая прямая (луч), проведенная из вершины треугольника, есть геометрическое место точек с постоянным отношением концентраций двух противолежащих компонентов. Например, в точках 1, 2 и 3, лежащих на луче, проведенном из вершины треугольника А (рис.71), отношение концентраций компонентов В и С постоянно и равно 2/1, причем по мере удаления точки от вершины А по лучу содержание компонента А в трехкомпонентной системе уменьшается, а содержание компонентов Б и С растет. Это правило применяется для определения изменения состава жидкой фазы, насыщенной одним из компонентов (в данном случае компонентом А).
Третья переменная, температура, изображается на осях, проведенных из вершин концентрационного треугольника перпендикулярно его плоскости. В результате объемная диаграмма состояния трехкомпонентной системы представляет собой трехгранную призму, ребра которой характеризуют состояние каждого из трех компонентов и одновременно являются осями температуры, а грани – состояние трех соответствующих бинарных систем АВ, АС и ВС. Геометрические элементы внутри призмы отражают состояние трехкомпонентной системы.
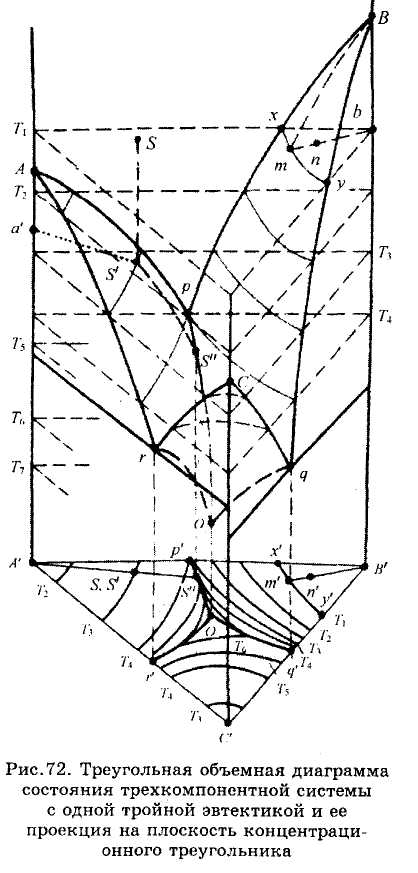
На рис. изображена объемная диаграмма состояния простейшей трехкомпонентной системы, компоненты которой неограниченно растворимы в жидком состоянии, кристаллизуются из расплава в чистом виде (твердых растворов нет), не образуют между собой химических соединений и не испытывают полиморфных превращений.
Точки А, В и С на этой диаграмме соответствуют температуре кристаллизации (или плавления) компонентов системы. Из этих точек берут начало по две линии ликвидус, расположенные на гранях призмы бинарных систем и пересекающиеся в точках двойных эвтектик р, q, r. В трехкомпонентной системе каждая пара этих линий служит границей поверхностей, показывающих, как и ликвидус бинарных систем, температуру начала кристаллизации одного из компонентов, соответственно А, В или С, а также состав жидкой фазы, насыщенной этим компонентом.
Точкам двойных эвтектик р, q и г в трехкомпонентной системе соответствуют линии двойных эвтектик рО, qO и rO, показывающие изменение состава жидкой фазы, насыщенной двумя компонентами (соответственно А и В, В и С, А и С) и являющиеся линиями пересечения каждой из двух поверхностей ликвидус. Точка О, расположенная на пересечении трех линий двойных эвтектик, соответствует наименьшей температуре на внешней поверхности диаграммы и называется точкой тройной эвтектики. Она показывает состав жидкой фазы, насыщенной одновременно тремя компонентами.
Основой топологии диаграммы является правило фаз Гиббса: F = К + п - Ф или при постоянном давлении F = 3 + 1 – Ф. Его следствия для трехкомпонентных систем:
одна фаза, например жидкая, имеет три степени свободы, т.е. одновременно могут меняться ее состав и температура, и поэтому ей соответствует определенный объем диаграммы;
две находящиеся в равновесии фазы имеют две степени свободы, т.е. переменный при заданной темпера туре состав, чему на объемной диаграмме соответствует поверхность, а на плоской диаграмме - линия;
три находящиеся в равновесии фазы обладают только одной степенью свободы (может меняться их температура) и поэтому при заданной температуре состав этих фаз строго фиксирован. Например, при кристаллизации из жидкости двойной эвтектики температура продолжает понижаться, но при этом состав эвтектической жидкости меняется по линии пересечения соответствующих поверхностей ликвидус;
если в равновесии находятся четыре фазы, а такое число фаз согласно правилу фаз Гиббса является максимальным, то система становится безвариантной. Этому состоянию системы на объемной диаграмме соответствует параллельная основанию призмы плоскость, на которой расположены фигуративные точки фаз постоянного состава, находящихся в равновесии при соответствующей постоянной температуре.
Например, при температуре Tq (рис.72), соответствующей точке тройной эвтектики О, число степеней свободы F = 0 и из жидкости, насыщенной тремя компонентами, происходит совместная кристаллизация этих компонентов по уравнению Ж0 = А + В + С. Температура остается постоянной до тех пор, пока не закончится кристаллизация.
Изометрическая проекция объемной диаграммы, хотя и наглядна, но неудобна. На практике обычно используют плоские диаграммы в концентрационном треугольнике по Гиббсу или Розебуму, которые являются
а) сечением объемной диаграммы при заданной температуре;
б) проекцией нескольких сечений при разных температурах.
