
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Двухкомпонентные конденсированные системы Построение диаграмм
В основе изучения и построения диаграмм состояния лежат два принципа: принцип непрерывности и принцип соответствия.
Принцип непрерывности: при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных ее фаз изменяются непрерывно. Свойства системы в целом тоже будут изменяться непрерывно, если не будет происходить изменения фазового состава.
Принцип соответствия: каждому комплексу фаз, находящихся в равновесии соответствует определенный геометрический образ на диаграмме состояния (поле или линия или точка).
Для построения диаграммы состояния прежде всего экспериментально изучают термические свойства компонентов. С этой целью готовят смеси компонентов различного исходного состава, нагревают каждую из них до полного плавления, а затем медленно (для достижения равновесия в системе) охлаждают, непрерывно регистрируя при этом температуру в смеси и время охлаждения. Полученные кривые охлаждения дают информацию, необходимую для построения диаграммы состояния. Любое фазовое превращение в системе, сопровождающееся изменением числа фаз и, следовательно, числа степеней свободы (начало и конец кристаллизации или плавления, изменение кристаллической модификации компонента, его агрегатного состояния, образование химических соединений компонентов и другие процессы, сопровождающиеся тепловыми эффектами и изменением теплоемкости фаз), нарушает непрерывности линий понижения температуры на кривых охлаждения: на них появляются перегибы, изменения наклона, температурные остановки. Диаграмма строится по температурам, отвечающим этим точкам на кривых охлаждения в зависимости от исходного состава систем.
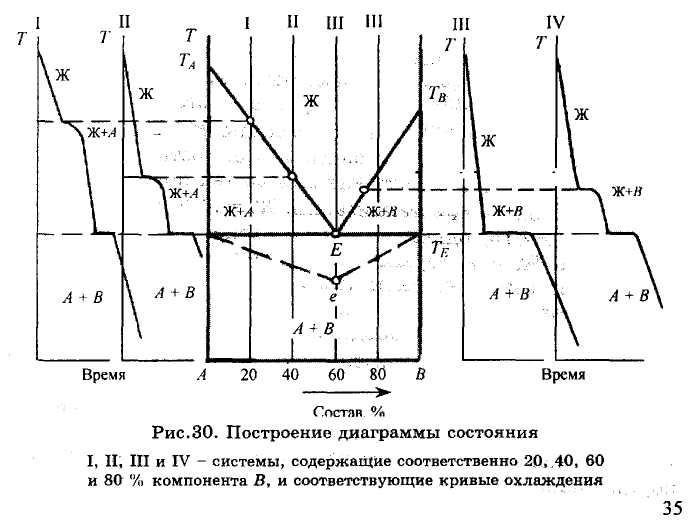
На рис.30 показан вид типовых кривых охлаждения, построенных для систем, содержащих 20, 40, 60 и 80 % компонента В. Вначале логарифмическая кривая показывает скорость охлаждения жидкой фазы, состоящей из двух компонентов. Система при этом имеет две степени свободы (F = 2 + 1-1 = 2), т.е. независимо могут меняться две переменные: температура и состав жидкой фазы.
Температура, при которой в расплаве появляются первые кристаллы твердой фазы любого состава, т.е. температура начала кристаллизации системы, соответствует на кривой охлаждения перегибу, возникающему благодаря выделению скрытой теплоты кристаллизации. Эта температура зависит от исходного состава системы. Число фаз при этом равно двум (жидкая и твердая), а число степеней свободы F = 2 + l-2 = l, т.е. температура продолжает понижаться, но с меньшей скоростью. Состав жидкой фазы после начала кристаллизации непрерывно меняется, она обедняется тем компонентом, который из нее кристаллизуется, и, соответственно, обогащается другим компонентом. Одновременно происходит изменение относительного количества фаз: количество жидкой фазы уменьшается, а твердой растет.
Эти изменения в системе приводят при определенной температуре к насыщению жидкой фазы одновременно двумя компонентами и их совместной кристаллизации из расплава. В результате число фаз в системе становится равным трем, а число степеней свободы F = 2 + 1–3 = 0. Система становится безвариантной, т.е. состав всех фаз и температура остаются постоянными до тех пор, пока не завершится процесс кристаллизации: Ж = А + В.
Жидкость, одновременно насыщенная двумя твердыми фазами, с которыми она находится в равновесии, называется эвтектической (или жидкой эвтектикой), а температура, соответствующая процессу ее кристаллизации и образованию однородной смеси двух твердых фаз, называемой твердой эвтектикой, эвтектической температурой.
Продолжительность температурных остановок на кривых охлаждения, связанных с кристаллизацией эвтектики, зависит от исходного состава системы и прямо пропорционально количеству эвтектической жидкости. Измеряя время этих остановок на кривых охлаждения, на изотерме диаграммы, соответствующей безвариантному равновесию, строят в условном масштабе так называемый треугольник Таммана. Вершина (е на рис.30) этого треугольника должна соответствовать составу той фазы, от количества которой зависит продолжительность безвариантного состояния системы, в данном случае эвтектической жидкости, содержащей 60 % компонента В. Треугольник Таммана позволяет проверить справедливость построения диаграммы состояния, особенно в случае изменения кристаллических модификаций компонентов.
Эвтектическая температура Те при Р = const имеет постоянное значение и не зависит от исходного состава системы. Она соответствует температуре исчезновения жидкой фазы, т.е. температуре конца кристаллизации системы. Когда остаются две твердые фазы, система приобретает одну степень свободы и, следовательно, возможность дальнейшего понижения температуры.
Таким образом, полученные экспериментальные данные позволяют построить диаграмму состояния и треугольник Таммана. Для этого в координатах состав системы - температура вначале откладывают температуры плавления чистых компонентов ТА и Тд, затем точки, отвечающие температурам начала и конца кристаллизации двухкомпонентных систем различного состава, определенные по кривым охлаждения, и продолжительность эвтектических температурных остановок. Далее, соединяя одноименные точки, проводят линии начала кристаллизации, показывающие также изменение состава жидкой фазы, насыщенной компонентом А (линия ТаЕ) или компонентом В (линия ТвЕ). Эти линии принято называть ликвидус. Они пересекаются в точке Е, называемой точкой двойной эвтектики, и поскольку она принадлежит одновременно двум линиям ликвидус, то показывает состав жидкой фазы, насыщенной двумя компонентами. Точки конца кристаллизации всех образцов, независимо от их исходного состава, располагаются на одной горизонтальной прямой – изотерме, соответствующей безвариантному состоянию системы при кристаллизации эвтектики.
По диаграммам состояния, построенным в масштабе, можно определить многие свойства системы:
Взаимную растворимость компонентов в жидком или твердом состоянии. Жидкие компоненты могут быть растворимы друг в друге неограниченно, образуя лишь одну жидкую фазу, или же ограниченно. В этом случае на диаграмме имеется область, ограниченная линиями растворимости, внутри которой в равновесии находятся две жидкие фазы (см. рис.18 и 19). Твердые компоненты могут кристаллизоваться из расплава в чистом виде (т.е. иметь постоянный состав, соответствующий вертикальным линиям диаграммы, как это изображено на рис.30) или образовывать твердые растворы изоморфного замещения или внедрения, т.е. твердые фазы переменного состава, область существования которых может быть неограниченной или ограниченной. В случае образования твердых растворов на диаграмме состояния появляются наклонные линии, называемые солидус и показывающие изменение состава этих твердых фаз при изменении температуры в процесс кристаллизации.
Температуру начала (появления кристаллов твердой фазы любого состава) и конца (исчезновения жидкой фазы) кристаллизации для систем любого состава.
Присутствие в системе химических соединений между компонентами, их состав (постоянный или переменный) и свойства, например, характер плавления химических соединений (плавится без разложения или с разложением).
Наличие полиморфных превращений компонентов и химических соединений, температуры этих превращений.
Число фаз и их состав по расположению фигуративных точек системы и фаз в каждом из полей диаграммы.
Число степеней свободы в любой фигуративной точке в заданном поле диаграммы, вычисляемое по правилу фаз Гиббса.
Относительное количество каждой фазы в системе заданного состава при заданной температуре, вычисляемое по правилу рычага в процентах от общей массы.
Характер кривой охлаждения образцов заданного исходного состава.
С последующим рентгенофазовым и микроскопическим анализом кристаллическую структуру сплавов различного состава, полученных по окончании кристаллизации, возможность изменения этой структуры в результате термической обработки (закалки или отпуска).
Кроме того, диаграммы состояния позволяют выбрать систему с заданной совокупностью свойств (например, наиболее жаростойкий, тугоплавкий сплав или, наоборот, наиболее легкоплавкий).
Все эти свойства систем легко определить, если знать, каким образом они выражаются графически на диаграммах состояния. С этой целью следует изучить определенный набор типовых диаграмм, каждая из которых позволяет судить об одном свойстве или совокупности свойств компонентов.
