
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Двухкомпонентные системы
Свойства двухкомпонентных (К = 2) систем определяются тремя независимыми переменными: давлением Р и температурой Т (внешние переменные), а также составом системы при условии его выражения в долях или процентах (по массе или мольных). В связи с этим диаграммы состояния таких систем должны быть объемными, построенными в трех измерениях: Р, Т, состав системы (рис.12).

Несмотря на то, что объемная диаграмма дает полную информацию о влиянии всех параметров на свойства двухкомпонентных систем, она неудобна. Поэтому для ее изображения на плоскости рассматривают различные проекции сечений диаграммы на плоскость: либо при постоянном давлении в координатах температура - состав
(изобарические сечения), либо при постоянной температуре (изотермические сечения) в координатах давление - состав (рис.13).
Д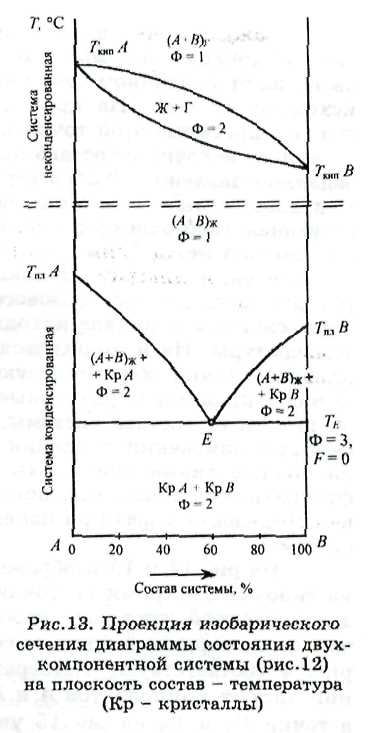 алеко
не всегда при изучении двухкомпонентных
систем требуется исследовать полную
диаграмму состояния. Как правило, в
одних случаях исследуются только
процессы кристаллизации и плавления,
в других - только процессы конденсации
и испарения. В связи с этим диаграмму
условно разделяют на две части:
неконденсированную систему (газ -
жидкость) при относительно высоких
температурах, при которых твердые фазы
отсутствуют, и конденсированную систему
(жидкость - кристаллы твердых фаз), в
которой газа уже нет.
алеко
не всегда при изучении двухкомпонентных
систем требуется исследовать полную
диаграмму состояния. Как правило, в
одних случаях исследуются только
процессы кристаллизации и плавления,
в других - только процессы конденсации
и испарения. В связи с этим диаграмму
условно разделяют на две части:
неконденсированную систему (газ -
жидкость) при относительно высоких
температурах, при которых твердые фазы
отсутствуют, и конденсированную систему
(жидкость - кристаллы твердых фаз), в
которой газа уже нет.
При изучении диаграмм состояния конденсированных систем обычно исследуют только изобарические сечения: либо одно при заданном постоянном давлении, либо несколько при различных давлениях, если помимо температуры и состава системы требуется изучить также влияние давления.
Двухкомпонентные неконденсированные системы
Неконденсированные системы изучают с помощью как изобарических сечений диаграмм их состояния (в координатах температура и состав), так и изотермических сечений в координатах давление -состав.
Следует иметь в виду, что каждое сечение диаграммы соответствует постоянному значению одной из внешних переменных (температуры или давления), и поэтому в уравнении, определяющем число степеней свободы системы по правилу фаз Гиббса, число внешних переменных уменьшается до единицы, т.е. в этом случае F = К + 1 - Ф. Следовательно, максимальное число фаз, находящихся в равновесии в таких системах, не превышает трех, системы с двумя фазами имеют одну степень свободы, а с одной – две степени свободы. Этим, в свою очередь, определяется физический смысл каждого геометрического элемента и топология всей диаграммы состояния в целом.
Каждая точка внутри диаграммы является фигуративной точкой системы, так как она характеризует ее свойства при заданном сочетании температуры, давления и исходного состава. На проекциях сечений объемной диаграммы проекция этой точки показывает свойства системы заданного исходного состава при заданной температуре или заданном давлении. Любая вертикальная прямая на проекции диаграммы – это линия постоянного состава, соответствующая либо одному из компонентов, либо химическому соединению между ними. Наклонные линии на изобарическом сечении диаграммы показывают зависимость температуры определенного фазового перехода от исходного состава системы и состава находящихся в равновесии фаз от температуры. На изотермических сечениях диаграммы наклонные линии характеризуют величину давления, при котором происходят различные фазовые превращения в зависимости от состава системы, а также изменение состава фаз при изменении давления в системе. Таким образом, наклонные линии диаграммы – это геометрическое место фигуративных точек фаз, показывающих изменение состава определенных фаз при изменении параметров состояния системы.
На рис.14 и 15 изображены проекции сечений одной из типовых диаграмм состояния двухкомпонентной неконденсированной системы, компоненты которой неограниченно растворимы в жидком состоянии. Точки Та и Tq на рис.14 соответствуют температурам кипения и конденсации чистых компонентов A vs. В при постоянном давлении, а точки Рд и Рв на рис.15 указывают давление пара над этими компонентами при заданной постоянной температуре. В этих точках в безвариантном равновесии находятся две фазы – жидкость и газ (F = 1 + 1 - 2 = 0), и поэтому температура и давление остаются постоянными до тех пор, пока не закончится испарение жидких компонентов или конденсация их паров.
Две наклонных линии, соединяющие указанные точки, разделяют диаграмму состояния двухкомпонентной системы на три поля. Два из них отвечают условиям


существования одной фазы, состоящей из двух компонентов: газа при низком давлении и высокой температуре или раствора жидких компонентов друг в друге при высоком давлении и низкой температуре. Система, представленная одной из этих фаз, имеет две степени свободы, т.е. одновременно может изменяться состав, а также температура или давление (точки 1 и 4 на рис.14 и 15).
Третье поле диаграммы, расположенное между наклонными линиями, представляет две находящиеся в равновесии друг с другом фазы: жидкость и насыщенный пар, имеющие различный состав и лишь одну степень свободы. Поскольку такая система является моновариантной (F = 2 + 1-2 = 1), состав этих фаз зависит от температуры и давления и при постоянном значении этих параметров также строго постоянен.
П арциальные
давления компонентов рА и рВ
обоих компонентов в паровой фазе
определяются законом Рауля (в приближении,
что пары подчиняются законам идеальных
газов)
арциальные
давления компонентов рА и рВ
обоих компонентов в паровой фазе
определяются законом Рауля (в приближении,
что пары подчиняются законам идеальных
газов)
![]()
или для бинарной системы
![]() и
и
![]() ,
,
где
![]() и
и
![]() – давление насыщенного пара чистого
компонента; хА и хВ
– мольная доля компонента А и В в жидкой
фазе.
– давление насыщенного пара чистого
компонента; хА и хВ
– мольная доля компонента А и В в жидкой
фазе.
И законом Дальтона:
![]() для бинарной системы.
для бинарной системы.
Состав газовой
фазы определяется уравнением:
![]()
Поскольку в бинарной системе хВ = 1 – хА, отношение парциальных давлений в паровой фазе определяется уравнением
 .
.
Парциальное давление компонента в газовой фазе pi кроме того связано с общим давлением пара РΣ через мольные доли обоих компонентов в паровой фазе уi:
![]() и
и
![]() .
.
Тогда
 .
.
Если компонент А более летуч, чем компонент В, то индекс при обозначении мольной доли его в жидкой и газовой фазе можно опустить:
![]() ,
,
где
![]() – относительная летучесть.
– относительная летучесть.
Последнее уравнение представляет зависимость между относительными концентрациями легкокипящего компонента в парах и в жидкости. Пар и жидкость различны по составу только тогда, когда α > 1. И лишь в этом случае возможно разделение компонентов при перегонке. Обогащение паров легко летучим компонентом чем больше, чем больше α, т.е. чем больше различаются давления насыщенных паров чистых компонентов.
В соответствии с первым законом Коновалова, состав жидкости и газа в состоянии равновесия различен, причем газ, по сравнению с жидкостью, богаче тем компонентом, добавление которого повышает общее давление пара над раствором, т.е. понижает температуру кипения раствора. Например, на рис.15 видно, что таким более летучим компонентом системы является вещество А, давление паров над которым при заданной температуре выше, чем у В, и поэтому, как следует из рис.14, температура кипения компонента А ниже, чем у В. Состав каждой из находящихся в равновесии фаз можно легко определить по наклонным линиям диаграммы. Линия жидкости РдЖРд диаграммы (рис.15), называемая также линией испарения, показывает изменение состава жидкости, а также общее давление пара над раствором в зависимости от концентрации его компонентов. Другая линия, РдГРд, называется линией газа или линией конденсации и показывает состав насыщенного пара, находящегося в равновесии с жидкостью. Изменение состава этих фаз при повышении давления в системе, содержащей 40 % компонента В, показано стрелками. Например, при давлении Рх — 0,8 атм (фигуративная точка системы X) в равновесии находятся жидкость, содержащая примерно 60 % компонента В и 40 % компонента А, и пар, который в соответствии с первым законом Коновалова содержит около 25 % компонента В и 75 % более летучего компонента А. Фигуративная точка системы X, а также точки Г и Ж, называемые фигуративными сопряженными точками находящихся в равновесии фаз (соответственно газа и жидкости), расположены на одной горизонтальной прямой, носящей название нода. Длина ноды ГЖ, а также отрезков ее, отсекаемых точкой X, позволяет рассчитать относительное количество находящихся в равновесии фаз.
По правилу рычага, количество находящихся в равновесии фаз пропорционально длине отрезков ноды, противолежащих фигуративным точкам этих фаз. При этом длина всей ноды пропорциональна общей массе фаз.
Например, в точке X, представляющей систему, состоящую из 40 % компонента В под давлением 0,8 атм и двух фаз: жидкой, содержащей 60 % компонента В, и газа, содержащего 25 % компонента В, - относительное количество жидкой фазы равно отношению длины отрезка XT (40 - 25 = 15) к длине ноды ЖГ, равной 60 - 25 = 35, т.е. 15/35 =- 0,43, или 43 % от общей массы. Количество газа равно отношению длин отрезков ЖХ и ЖГ: 20/35 = 0,57, или 57 % от общей массы системы. При повышении давления в системе от точки 2 до точки 3' количество газа уменьшается со 100 % до 0, а количество жидкой фазы растет от 0 до 100 % .
При использовании правила рычага следует обратить внимание на способ выражения состава двухкомпонентной системы. Если состав выражен в долях или процентах по массе, то в тех же единицах определяется по правилу рычага и относительное количество фаз. В том случае, когда для выражения состава системы применены мольные доли или проценты, относительное количество находящихся в равновесии фаз будет выражено также в мольных долях или процентах.
На практике чаще используются изобарические сечения диаграмм ГЖ (см. рис.14). Линия конденсации ТдГТв на этой диаграмме позволяет определить температуру начала конденсации паров в зависимости от их состава, а также изменение состава насыщенных паров в процессе их конденсации при изменении температуры. Линия испарения жидкости ТдЖТв показывает температуру конца конденсации паров при охлаждении системы или температуру начала испарения жидкости при нагревании в зависимости от исходного состава системы. Эта же линия позволяет определить изменение состава жидкой фазы, находящейся в равновесии с паром, при изменении температуры.
Диаграмма дает возможность увидеть, не прибегая к эксперименту, какие изменения происходят в системе любого исходного состава при изменении температуры. Например, при охлаждении газа, содержащего 40 % компонента В, от 600 до 200 °С, т.е. при движении фигуративной точки системы от точки 1 до точки 4 (см. рис.14), его конденсация начинается при температуре 500 °С, отвечающей точке 2, лежащей на линии газа, а жидкость, которая появляется при этой температуре, содержит 80 % компонента В, что соответствует точке 2' на линии жидкости. Далее, при понижении температуры от точки 2 до точки 3', состав газа непрерывно меняется по линии газа от точки 2 до точки 3, а состав жидкости – по линии испарения от точки 2' до точки 3'. Одновременно происходит изменение количественного соотношения находящихся в равновесии фаз: количество газа непрерывно уменьшается, а количество жидкости растет, причем его можно вычислить, пользуясь правилом рычага. Так, например, при 400 °С нода, соединяющая фигуративные точки газа Г и жидкости Ж, разделена фигуративной точкой системы X на два отрезка. Длина отрезка ЖХ пропорциональна количеству газа, а отрезка XT - количеству жидкой фазы. Конденсация газа заканчивается при температуре 275 °С, при которой исчезают остатки газа состава, отвечающего точке 3, и остается жидкая фаза, состав которой отвечает исходному составу системы: 40 % компонента Б (точка 3').
На рис.16 приведена одна из типовых диаграмм состояния двухкомпонентной изобарической неконденсированной системы. Во многих случаях наблюдаются весьма значительные отклонения свойств растворов реальных веществ от свойств идеальных растворов. Поэтому на диаграммах состояния на линиях газа и жидкости отмечают экстремальные точки: максимум или минимум. Если имеет место отрицательное отклонение от давления паров, отвечающего идеальным растворам, на линиях газа и жидкости изотермической бинарной системы появляется минимум, которому на изобарической диаграмме соответствует максимальная температура кипения (рис.17, а). При положительных отклонениях от свойств идеальных растворов на кривых газа и жидкости может появиться максимум, при этом максимальному давлению пара отвечает минимальная температура кипения (рис.17, б).
Отклонения от закона Рауля связаны с изменением активности молекул в растворе, которое обусловлено взаимодействием молекул – процессы диссоциации, ассоциации, сольватации и т.п. Степень отклонения от идеальности определяется величиной коэффициента активности.
Для бинарной системы
![]() и
и
![]()
В случае положительных отклонений P > Pиг; γ > 1; возможна диссоциация; ЕА+В < EA+A, EB+B; Теплота испарения > 0; |
В случае отрицательных отклонений P < Pиг; γ < 1; возможна ассоциация; ЕА+В > EA+A, EB+B; Теплота испарения < 0; |
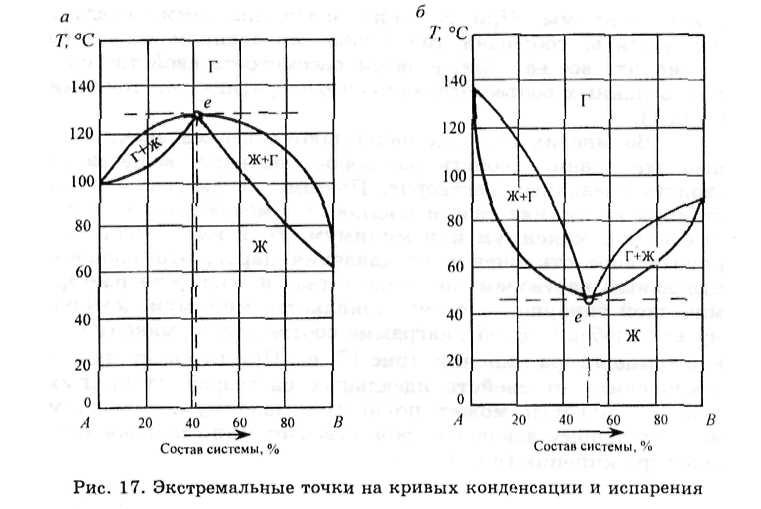
Второй закон Коновалова гласит: «В экстремальных точках диаграммы составы жидкости и газа одинаковы, и этим точкам соответствует общая горизонтальная касательная». Жидкости, состав которых соответствует экстремумам на диаграммах, называются азеотропными или нераздельно кипящими.
К образованию азеотропов склонны смеси с сопоставимыми температурами (давлениями) кипения.
Различия в составе жидких фаз и паров широко используются при разделении веществ методом простой или фракционной перегонки (дистилляции). Если на диаграмме состояния нет экстремальных точек, то можно получить компоненты в чистом виде, в противном случае фракционная перегонка позволяет получить чистым лишь один из компонентов и азеотропную жидкость, содержащую оба компонента.
На типовых диаграммах состояния бинарных систем с ограниченной растворимостью компонентов в жидком состоянии (рис.18), помимо линий конденсации и испарения, имеются линии, показывающие взаимную растворимость, т.е. концентрацию насыщенных растворов компонентов. На рис.18 линия СМ показывает растворимость компонента А в В, а линия CN - растворимость компонента В в А в зависимости от температуры. Как следует из диаграммы, с ростом температуры взаимная растворимость компонентов увеличивается и выше точки С, называемой точкой Алексеева, становится неограниченной.
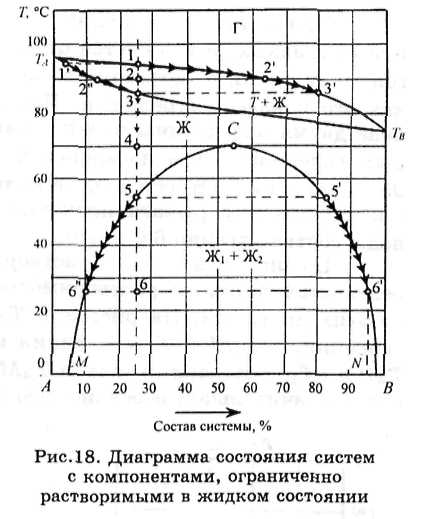
Поле диаграммы, расположенное левее линии СМ и правее линии CN, представлено ненасыщенными растворами компонента В в А и А в В. В области диаграммы, расположенной между линиями растворимости, присутствуют две насыщенные жидкие фазы, между которыми имеются видимые границы раздела, и по правилу фаз система обладает только одной степенью свободы, т.е. при заданной температуре составы этих жидких фаз строго определенны, а их относительное весовое количество можно вычислить по правилу рычага. Например, диаграмма, представленная на рис.18, показывает, что конденсация пара, содержащего 25 % компонента В, начинается при температуре 94 °С (точка 1) и заканчивается при 86 °С (точка 3), после чего охлаждаемая жидкая фаза расслаивается при 55 °С (точка 5) на две жидкие фазы, одна из которых при указанной температуре содержит 25 % компонента В, а другая 80 % (точка 5').
При дальнейшем понижении температуры состав одной из жидких фаз меняется от точки 5 до точки 6", а другой — от точки 5' до точки 6' по линиям растворимости, как это показано стрелками. При 26 °С система представлена двумя насыщенными жидкими фазами, одна из которых содержит 10 % компонента В (точка 6"), а другая 95 % (точка 6'). Относительное количество первой и второй фаз по правилу рычага пропорционально длине отрезков ноды соответственно 6'6 и 6"6.
На рис.19 взаимная растворимость компонентов определяется линиями растворимости Mm и Nn на каждой из этих диаграмм. На рис.19, a TAD и TBD - линии конденсации, а ТАМ и TBN - линии испарения. На рис.19, б ТАР и РТВ - это линии газа, а ТАМ и NTb - линии жидкости. Отличительной особенностью этих диаграмм является

наличие на них горизонтальных прямых, соответствующих безвариантному состоянию системы (F = 0) и, следовательно, равновесию между тремя фазами.
Г оризонтальные
прямые на изобарических сечениях
диаграмм - это линии постоянной температуры
(изотермы), а на изотермических сечениях
- линии постоянного давления (изобары).
В точках на горизонтальных прямых
система становится безвариантной (F
= 0), так как в равновесии при постоянном
давлении и постоянной температуре
находятся три фазы, состав которых также
остается постоянным. Такое состояние
системы сохраняется, пока в результате
протекающих между фазами процессов
число фаз не уменьшится и система не
приобретет хотя бы одну степень свободы.
Так, при конденсации газа состава,
отвечающего точке D,
образуются одновременно две жидкие
фазы, состав которых соответствует
точкам М и jV,
т.е. протекает процесс TD
о Жм + Ждг (рис.19, а). На изотерме
рис.19, б в равновесии также находятся
три фазы, однако взаимодействие между
ними протекает по схеме Гр+ Жд/сэ Ждг, в
чем легко убедиться, определив, используя
правило рычага, изменение количества
фаз на изотермах диа- грамм. Для этого
предварительно задаются произвольным
значением исходного состава системы и
вычисляют по правилу рычага количество
фаз чуть выше и чуть ниже изотермы
диаграммы.
оризонтальные
прямые на изобарических сечениях
диаграмм - это линии постоянной температуры
(изотермы), а на изотермических сечениях
- линии постоянного давления (изобары).
В точках на горизонтальных прямых
система становится безвариантной (F
= 0), так как в равновесии при постоянном
давлении и постоянной температуре
находятся три фазы, состав которых также
остается постоянным. Такое состояние
системы сохраняется, пока в результате
протекающих между фазами процессов
число фаз не уменьшится и система не
приобретет хотя бы одну степень свободы.
Так, при конденсации газа состава,
отвечающего точке D,
образуются одновременно две жидкие
фазы, состав которых соответствует
точкам М и jV,
т.е. протекает процесс TD
о Жм + Ждг (рис.19, а). На изотерме
рис.19, б в равновесии также находятся
три фазы, однако взаимодействие между
ними протекает по схеме Гр+ Жд/сэ Ждг, в
чем легко убедиться, определив, используя
правило рычага, изменение количества
фаз на изотермах диа- грамм. Для этого
предварительно задаются произвольным
значением исходного состава системы и
вычисляют по правилу рычага количество
фаз чуть выше и чуть ниже изотермы
диаграммы.
Пример 1. Обозначить поля диаграммы (рис. 5), дать характеристику компонентов системы. Описать путь конденсации системы, содержащей 45 % компонента В (точка М), заполнить таблицу 2.
Решение. 1. Пронумеровать поля диаграммы (обычно – римскими цифрами).
2. Дать наименование полей диаграммы: поле I – газ (пар); поле II – пар + жидкость; поле III – жидкость.
3. Дать характеристику диаграммы: двухкомпонентная неконденсированная система с неограниченной растворимостью компонентов в жидкой фазе.
4. Путь конденсации системы – вертикальная пунктирная линия вниз от точки М (рис. 6), на которой отмечены фигуративные точки М1, М2, М3, соответствующие началу процесса (М1), образованию двухфазной системы (М2) и окончанию конденсации (М3)
Точка |
Исходный состав системы, % В |
Кол-во фаз в точке |
Наим. фаз |
Состав каждой фазы, % В |
Относит. кол-во фаз, % |
Температура конденсации |
C |
|
ТН |
ТK |
|||||||
М |
45 |
1 |
Г |
45 |
100 |
78 |
51 |
2 |
М1 |
45 |
2 |
Г |
45 |
ГЖ |
78 |
51 |
1 |
Ж |
82 |
|||||||
М2 |
45 |
2 |
Г |
27 |
55 |
78 |
51 |
1 |
Ж |
69 |
45 |
||||||
М3 |
45 |
2 |
Г |
13 |
ГЖ |
78 |
51 |
1 |
Ж |
45 |
|||||||
5. Определить состав системы в точке М, для чего следует опустить перпендикуляр от точки М на ось составов. Состав точки М – 45 % гептана C7H16 – компонента В. Он же будет общим составом системы для всех остальных точек. Точка М находится в поле I, следовательно, число фаз – 1 шт. Наименование фазы – пар; состав совпадает с общим составом системы.
6. Температуру начала конденсации определить по месту пересечения перпендикуляра из точки М и линии газа (граничной линии между полем I и II) – точка М1. От точки М1 провести горизонталь на ось температур. Температура начала конденсации равна 78°С. Она остается одинаковой для всех рассматриваемых точек.
7. Определить число степеней свободы в точке М:
С = К − Ф + 1 = 2 − 1 + 1 = 2
8. Определить фазовый состав в точке М1. Точка М1 находится на линии конденсации, следовательно, количество фаз – 2 шт: газ и жидкость.
9. Определить состав жидкости в точке М1, для этого от этой точки провести ноду до пересечения с линией жидкости (или линией испарения) и от точки пересечения опустить перпендикуляр на ось составов (позиция ЖМ1 на рис. 6). Состав жидкости – 82 % C7H16.
10. Определить относительное количество фаз в точке М1: так как М1 находится на линии равновесия между двумя фазами, то относительное их количество не определяется. В такой ситуации следует записать уравнение равновесия. В данном случае – Ж Г.
11. Определить число степеней свободы в точке М1:
С = К − Ф + 1 = 2 − 2 + 1 = 1.
12. Определить фазовый состав точки М2, которая находится в поле II, следовательно, число фаз – 2 шт.: жидкость и газ.
13. Определить состав жидкости и газа в точке М2: провести ноду до пересечения с линий испарения (точка X) с одной стороны и с линией конденсации (точка Y) с другой стороны. От точек пересечения опустить перпендикуляры на ось составов. Перпендикуляр от линии конденсации определяет состав газа (27 % гептана – точка ГМ2 на рис. 6), от линии испарения – состав жидкой фазы (69 % гептана – точка ЖМ2 на рис. 6).
14. Определить относительное количество фаз в точке М2. В соответствии с правилом рычага
![]() 45%;
45%;
![]() 55 %.
55 %.
15. Определить число степеней свободы в точке М2:
С = К − Ф + 1 = 2 − 2 + 1 = 1.
16. Температуру завершения процесса конденсации определить по месту пересечения перпендикуляра из точки М и линией испарения – точка М3. От точки М3 провести горизонталь на ось температур. Температура завершения конденсации равна 51°С. Она остается одинаковой для всех рассматриваемых точек.
17. Определить фазовый состав в точке М3. Точка М3 находится на линии испарения, следовательно, количество фаз – 2 шт: газ и жидкость.
18. Определить состав пара в точке М3, для этого от этой точки провести ноду до пересечения с линией конденсации и от этой точки опустить перпендикуляр на ось составов (позиция ГМ3 на рис. 6). Состав пара – 13 % C7H16.
19. Определить относительное количество фаз в точке М3: так как М3 находится на линии равновесия между двумя фазами, то относительное их количество не определяется. В такой ситуации следует записать уравнение равновесия. В данном случае – Ж Г.
20. Определить число степеней свободы в точке М3:
С = К − Ф + 1 = 2 − 2 + 1 = 1.
Пример 2. Обозначить поля диаграммы (рис. 7), дать характеристику компонентов системы. Определить изменение состава и количества фаз в системе, содержащей 25 % анилина при охлаждении ее от 170 до 60°С с интервалом 40°С. Нанести на диаграмму соответствующие фигуративные точки систем и фаз, заполнить таблицу.
Решение. 1. Пронумеровать поля диаграммы (обычно – римскими цифрами).
2. Дать наименование полей диаграммы: поле I – жидкость (пар); поле II – область расслоения двух жидкостей.
3. Дать характеристику диаграммы: двухкомпонентная неконденсированная система с ограниченной растворимостью компонентов в жидкой фазе.
4. Отметить исследуемый состав системы, соответствующий содержанию анилина C2H5NH2 25 % и отметить фигуративные точки N, N1, N2, соответствующие заданному температурному интервалу.
5 .
Определить фазовый состав в каждой
точке. Точка N принадлежит
к полю I, следовательно,
количество фаз – 1 шт. – жидкость,
содержащая 25 % анилина. Точки N1
и N2 принадлежат
полю II, где происходит
расслаивание системы на две жидкости
разного состава, следовательно, количество
фаз – 2 шт. Состав жидкостей зависит
от температуры.
.
Определить фазовый состав в каждой
точке. Точка N принадлежит
к полю I, следовательно,
количество фаз – 1 шт. – жидкость,
содержащая 25 % анилина. Точки N1
и N2 принадлежат
полю II, где происходит
расслаивание системы на две жидкости
разного состава, следовательно, количество
фаз – 2 шт. Состав жидкостей зависит
от температуры.
6. Определить состав расслаивающихся жидкостей в точках N1 и N2, как показано на рис. 7b и зафиксировано в табл. 2. При этом следует учитывать, что жидкость 1 представляет насыщенный раствор анилина в воде, а жидкость 2 – раствор воды в анилине. Соответственно точки X и P отображают состав Ж1, а точки Y и R – состав жидкости 2.
7. Пользуясь правилом рычага определить относительное количество каждой фазы.
Для точки N1:
![]() 80 %;
80 %;
![]() 20 %.
20 %.
Для точки N2:
![]() 75 %;
75 %;
![]() 25 %.
25 %.
Точка |
Исходный состав системы, % В |
Количество фаз в точке |
Наименование фаз |
Состав каждой фазы, % В |
Относительное количество фаз, % |
N |
25 |
1 |
Ж |
25 |
100 |
N1 |
25 |
2 |
Ж1 |
12 |
20 |
Ж2 |
78 |
80 |
|||
N2 |
25 |
2 |
Ж1 |
5 |
25 |
Ж2 |
88 |
75 |
