
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
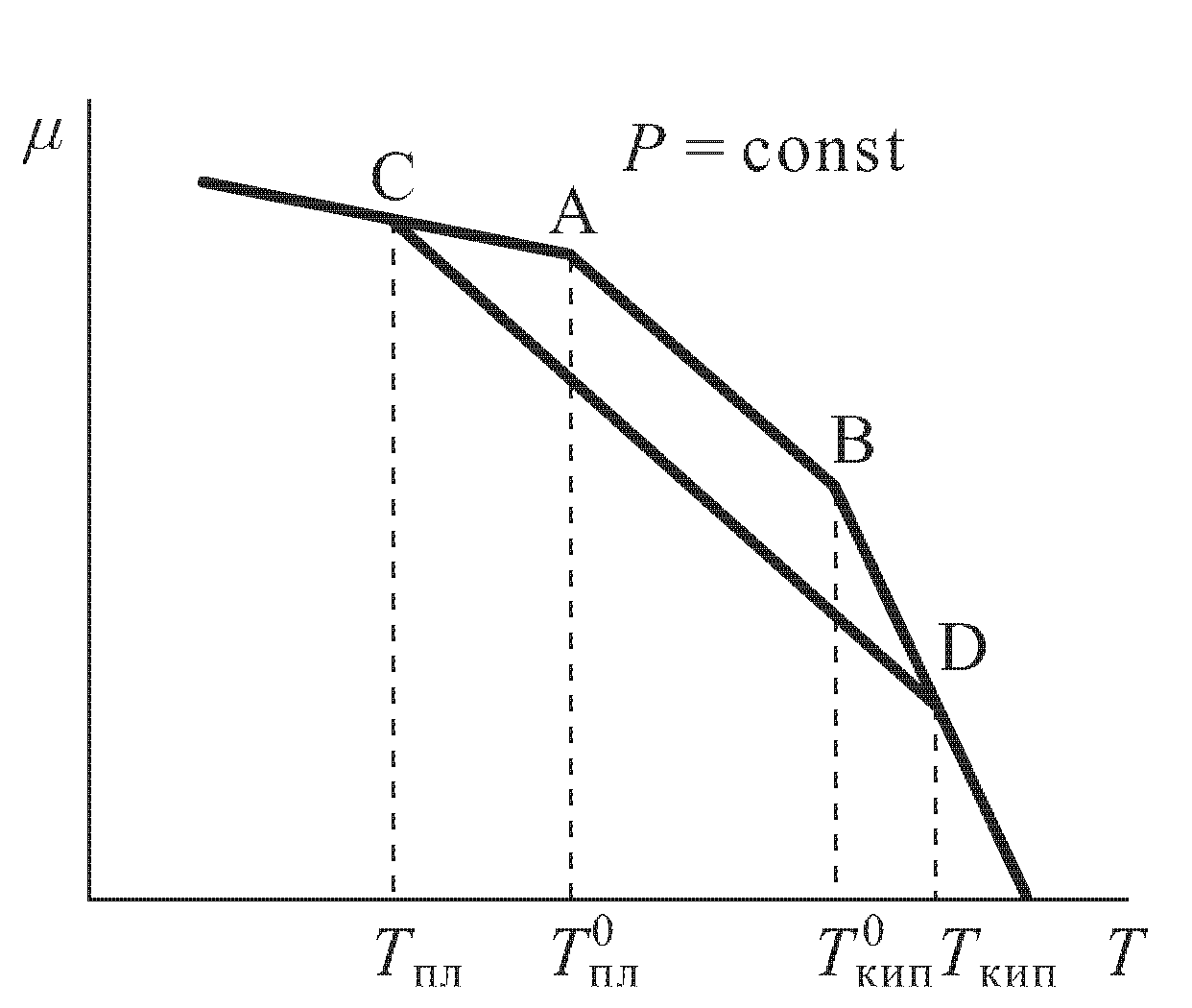
Зависимость химического потенциала от температуры
Зависимость химического потенциала от температуры для чистого вещества (в данном примере – растворителя), будучи представлена графически, имеет три кривые, соответствующие твердому, жидкому и газообразному состояниям.
Поскольку
![]() ,
а S(s)
< S(l)
< S(g),
то углы наклона касательных к зависимости
,
а S(s)
< S(l)
< S(g),
то углы наклона касательных к зависимости
![]() будут увеличиваться по мере повышения
температуры (энтропия зависит от
температуры), а в точках фазового перехода
претерпевать изломы, так как при этом
энтропия меняется скачком.
будут увеличиваться по мере повышения
температуры (энтропия зависит от
температуры), а в точках фазового перехода
претерпевать изломы, так как при этом
энтропия меняется скачком.
Точка А характеризуется фазовым переходом – плавлением растворителя; ей соответствует температура плавления Тm. Точка В соответствует процессу испарения с температурой кипения Ткип.
Химический потенциал
растворителя при образовании раствора,
в соответствии с теорией идеальных
растворов, понижается на величину
![]() .
Поэтому кривая
для раствора пойдет ниже соответствующей
зависимости для чистого растворителя.
Точки пересечения этой кривой с
зависимостями
для твердой и газообразной фаз чистого
растворителя С и D указывают соответственно
на температуры кристаллизации Тпл и
кипения Ткип раствора. Из графика видно,
что температура плавления (кристаллизации)
понижается при добавлении растворенного
вещества, а температура кипения
повышается. При этом по абсолютной
величине
.
Поэтому кривая
для раствора пойдет ниже соответствующей
зависимости для чистого растворителя.
Точки пересечения этой кривой с
зависимостями
для твердой и газообразной фаз чистого
растворителя С и D указывают соответственно
на температуры кристаллизации Тпл и
кипения Ткип раствора. Из графика видно,
что температура плавления (кристаллизации)
понижается при добавлении растворенного
вещества, а температура кипения
повышается. При этом по абсолютной
величине
![]() и адекватны экспериментальным данным
для реальных растворов.
и адекватны экспериментальным данным
для реальных растворов.
Химический потенциал в газах
Ситуация идеального газа
Для начала рассмотрим
ситуацию, когда есть идеальный газ –
чистое вещество. В этой ситуации
химический потенциал идеального газа
равен его энергии Гиббса:
![]() .
.
Энергия Гиббса
является функцией давления, температуры
и состава. Т.к. взято чистое вещество,
то
![]() и ее изменение описывается дифференциальным
уравнением:
и ее изменение описывается дифференциальным
уравнением:
![]()
Ограничим систему
по температуре (T = const).
Тогда
![]() и с учетом свойства энергии Гиббса как
характеристической функции
и с учетом свойства энергии Гиббса как
характеристической функции
![]() изменение
химического потенциала определяется
дифференциальным уравнением:
изменение
химического потенциала определяется
дифференциальным уравнением:
![]()
Применив уравнение
Менделеева-Клапейрона
![]() для 1 моль газа и подставив полученное
выражение для V в
дифференциальное уравнение химического
потенциала идеального газа получим:
для 1 моль газа и подставив полученное
выражение для V в
дифференциальное уравнение химического
потенциала идеального газа получим:
![]() откуда
откуда
![]() ,
,
где μ* – постоянная интегрирования.
Для определения μ* используют представление о т.н. стандартном состоянии (P = 1 атм., Т = 298 K)
С учетом стандартного состояния уравнение химического потенциала:
![]() ,
,
где
![]() – стандартный химический потенциал,
– стандартный химический потенциал,
![]() – относительное давление;
– относительное давление;
![]() – отношение текущего парциального
давления идеального газа к его давлению
в стандартных условиях. Относительное
давление – величина безразмерная, но
численно относительное давление равно
парциальному давлению газа, выраженному
в атмосферах.
– отношение текущего парциального
давления идеального газа к его давлению
в стандартных условиях. Относительное
давление – величина безразмерная, но
численно относительное давление равно
парциальному давлению газа, выраженному
в атмосферах.
Изменение химического потенциала
![]()
Если будет смесь идеальных газов, то для компонента смеси:
![]() и
и
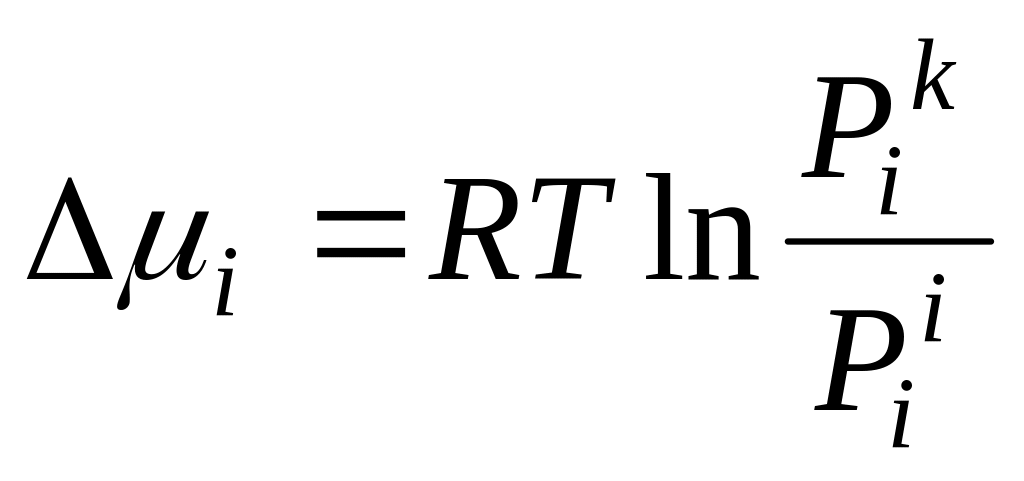
Химический потенциал реального газа
В ситуации реального газа необходим учитывать взаимодействие молекул газа друг с другом. Взаимодействие не обязательно химическое. Может определяться электростатическим и другими видами взаимодействия молекул.
Для учета взаимодействий молекул друг с другом Льюис предложил использовать понятие фугитивности в уравнении химического потенциала идеального газа:
![]() для однокомпонентной
системы
для однокомпонентной
системы
![]() для
смеси неидеальных газов
для
смеси неидеальных газов
В обоих уравнениях
–
стандартный химический потенциал. За
стандартное состояние газа принимают
гипотетический газ при 298 K
и 1 атм. со свойствами идеального газа
(![]() =1,
а f0 = Р0);
– относительная фугитивность газа.
Аналогично относительному парциальному
давлению,
=1,
а f0 = Р0);
– относительная фугитивность газа.
Аналогично относительному парциальному
давлению,
![]() ,
где f0 – стандартная
фугитивность – фугитивность газа в
стандартном состоянии, относительная
фугитивность численно равна фугитивности,
выраженной в атмосферах.
,
где f0 – стандартная
фугитивность – фугитивность газа в
стандартном состоянии, относительная
фугитивность численно равна фугитивности,
выраженной в атмосферах.
Изменение химического потенциала неидеального газа:
![]() для
однокомпонентной системы
для
однокомпонентной системы
 для смеси неидеальных
газов
для смеси неидеальных
газов
Фугитивность
По Льюису фугитивность – величина, которую нужно подставить в выражение химического потенциала идеального газа, чтобы получить значение химического потенциала для реального газа.
Величина фугитивности связана с парциальным давлением газа уравнением:
![]() ,
,
где Р – давление газа, γ – коэффициент фугитивности.
Таким образом, величина фугитивности f включает в себя понятие концентрации (для газов – парциальное давление) и поправку на неидеальность системы γ.
Фугитивность имеет такую же размерность, как и давление. Ее величина не зависит от размерности давления. Коэффициент фугитивности величина безразмерная, величина коэффициента фугитивности в одних и тех же условиях состояния газа зависит от единиц измерения.
Обычно коэффициент фугитивности меньше единицы. При увеличении давления газа коэффициент фугитивности уменьшается до какого-то предела, но затем может и увеличиваться. При больших давлениях, когда силы притяжения преобладают над силами отталкивания, коэффициент фугитивности может быть больше единицы.
К использованию фугитивности на практике прибегают при давлениях в системе, больших 50 атм. При меньших давлениях при выполнении приближенных вычислений, определением фугитивности пренебрегают.
Для нахождения фугитивности необходимы данные до парциальному давлению и коэффициенту фугитивности.
Коэффициент фугитивности определяют по экспериментальным данным.
С использованием справочных данных коэффициент активности можно определить, например, по методу соответственных состояний.
Принцип соответственных состояний: при одинаковых параметрах все газы обладают приблизительно одинаковыми свойствами.
Приведенный параметр – это отношение данного параметра (давления, температуры) к его критическому значению.
Приведенное
давление
![]() ;
;
Приведенная
температура
![]()
Критические значения температуры и давления приводятся в справочной литературе.
Для определения коэффициента фугитивности пользуются специальными таблицами:
-
 π
πτ

γ
