
- •1. Элементы зонной теории. Металлы, диэлектрики, полупроводники. Ковалентная связь между атомами полупроводниковых материалов.
- •2. Образование свободных носителей заряда в беспримесных полупроводниках.
- •3. Образование свободных носителей заряда в примесных полупроводниках.
- •4. Вырожденные и невырожденные полупроводники. Компенсированные полупроводники. Предельная растворимость примеси.
- •5. Законы распределения носителей в зонах полупроводника.
- •6. Концентрация носителей в полупроводнике. Концентрация носителей и положение уровня Ферми в собственном полупроводнике.
- •7. Концентрация носителей и положение уровня Ферми в примесных полупроводниках.
- •8. Связь между концентрациями основных и неосновных носителей. Закон действующих масс.
- •9. Зависимость положения уровня Ферми от температуры.
- •10. Зависимость концентрации носителей заряда в полупроводниках от температуры.
- •11. Электронные процессы в полупроводниках. Дрейф и диффузия носителей заряда в полупроводниках.
- •12. Факторы, определяющие подвижность носителей.
- •13. Температурная зависимость удельной проводимости полупроводников.
- •14. Однородные и неоднородные полупроводники. Встроенное электрическое поле.
- •15. Неравновесные носители заряда в полупроводниках.
- •16. Генерация и рекомбинация носителей.
- •17. Время жизни неравновесных носителей.
- •18. Уравнение непрерывности. Время диэлектрической релаксации.
- •19. Электронно-дырочный переход. Равновесное состояние p-n перехода.
- •20. Напряженность электрического поля и распределение потенциалов в резком p-n переходе.
1. Элементы зонной теории. Металлы, диэлектрики, полупроводники. Ковалентная связь между атомами полупроводниковых материалов.
Полупроводники
можно условно выделить из других веществ
по значению удельного сопротивления
.
Так, у металлов:
![]() Омсм,
у полупроводников:
Омсм,
у полупроводников:
![]() Омсм,
у диэлектриков
Омсм,
у диэлектриков
![]() Омсм.
Однако отличие полупроводников от
металлов не столько количественное,
сколько качественное. Полупроводник
– вещество, основным свойством которого
является сильная зависимость удельной
проводимости от воздействия внешних
факторов (температуры, электрического
поля, света и др.)
Омсм.
Однако отличие полупроводников от
металлов не столько количественное,
сколько качественное. Полупроводник
– вещество, основным свойством которого
является сильная зависимость удельной
проводимости от воздействия внешних
факторов (температуры, электрического
поля, света и др.)
Удельное сопротивление полупроводников с ростом температуры падает, а у металлов растёт, введение посторонней примеси в металл увеличивает сопротивление, а у полупроводникового материала ничтожная концентрация атомов примеси может уменьшить его удельное сопротивление на несколько порядков. Различия в свойствах металлов, диэлектриков и полупроводников объясняются различной зонной структурой этих материалов.
Элементы зонной теории
Отдельный атом представляется как система, состоящая из положительно заряженного ядра и электронов, вращающихся вокруг ядра по эллиптическим орбитам. Число электронов в атоме определяется зарядом его ядра.
В изолированном атоме электроны распределены по строго определенным энергетическим состояниям или энергетическим уровням. Расстояния между последовательными уровнями непрерывно уменьшаются по мере увеличения энергии (рис.1.1).

Рис. 1.1. Энергетические уровни изолированного атома
Распределение электронов по этим уровням подчиняется принципу Паули, согласно которому на одном энергетическом уровне не может находиться более двух электронов. Поэтому в атоме, электроны, хотя и стремятся занять состояния с наименьшей энергией, занимают и нижние энергетические уровни, и уровни, более удаленные от ядра. Все нижние уровни оказываются заполненными до предела, а часть верхних энергетических уровней в невозбужденном состоянии атома оказываются свободными.
В твердом теле атомы сближаются друг с другом настолько, что их электронные оболочки перекрываются, и между ними начинается взаимодействие. В результате каждый энергетический уровень дискретного атома расщепляется на ряд уровней, число которых равно числу взаимодействующих атомов, и из каждого уровня образуется энергетическая зона. Чем меньше расстояние между атомами d, тем сильнее взаимодействие оболочек и тем шире оказываются их энергетические зоны. При непрерывном сближении атомов первыми начинают взаимодействие внешние электронные оболочки, и так как соответствующие им верхние энергетические уровни дискретного атома располагаются плотно, то соответствующие энергетические зоны, образованные из верхних уровней могут перекрываться друг с другом, образуя единую зону. Взаимодействие нижних электронных оболочек ослаблено экранирующим действием верхних оболочек, поэтому нижние энергетические уровни размываются слабее верхних. В результате равновесному состоянию между атомами d0 в твёрдом теле соответствует определённая зонная диаграмма (рис.1.2.).

Рис.1.2. Образование энергетических зон твердого тела из энергетических уровней отдельного атома
Зонная диаграмма представляет собой ряд энергетических зон разрешённых значений энергии электрона, отделённых друг от друга так называемыми запрещенными зонами шириной (в энергетическом масштабе) E31, E32 и т.д. Электрон не может находиться внутри запрещённой зоны, т.е. не может иметь значения энергии, соответствующие энергетическим промежуткам E31, E32. Каждая разрешённая зона состоит из дискретных энергетических уровней. Число уровней в зоне равно числу взаимодействующих атомов. Для грубой оценки числа этих уровней в зоне предполагается, что взаимодействие атомов не распространяется за пределы объема равного 1 см3. Так как в твёрдом теле в 1 см3 содержится примерно 1022 атомов, то такой же порядок имеет и число уровней в зоне. Ширина разрешённой зоны обычно не превышает нескольких электронвольт. Поэтому энергетический промежуток не между отдельными уровнями в зоне не больше 10-22 эВ. Такая малая величина этого промежутка во многих случаях позволяет считать, что энергетический спектр электронов в пределах разрешённых зон практически непрерывен. Верхний энергетический уровень разрешённой зоны называется потолком, нижний – дном. При наличии внешнего электрического поля силы этого поля, ускоряя электроны, увеличивают их кинетическую энергию, что на энергетической диаграмме соответствует переходу электронов на более высокие энергетические уровни. Однако такой переход возможен лишь в том случае, если в пределах одной разрешённой зоны имеются заполненные электронами уровни и свободные. Тогда, благодаря малости энергетических промежутков между уровнями в зоне, даже слабые электрические поля могут переводить электроны с одного уровня на другой, т.е. создавать направленное движение электронов в твёрдом теле - электрический ток. Если же разрешённая зона заполнена электронами полностью, т.е. на каждом энергетическом уровне находится по два электрона, то электроны в такой зоне не имеют возможности изменять свою энергию и участвовать в электропроводности. Перевести электроны в соседнюю незаполненную зону силы электрического поля не могут, так как энергия, которую они сообщают электронам, обычно много меньше ширины запрещённой зоны E3. Степень заполнения зоны электронами определяется степенью заполнения соответствующего энергетического уровня дискретного атома, из которого эта зона образовалась. Очевидно, что нижние энергетические уровни атома, а, следовательно, и соответствующие им нижние энергетические зоны оказываются заполненными полностью. Частично свободными или полностью свободными могут быть лишь самые верхние энергетические уровни атома, а значить и верхние зоны твёрдого тела. Электроны только этих зон могут изменять свою энергию и переносить электрический ток. Поэтому при рассмотрении процессов электропроводности твёрдых тел можно рассматривать лишь структуру двух верхних зон. Самую верхнюю зону называют зоной проводимости, вторую – валентной зоной. Валентная зона образована при расщеплении энергетических уровней валентных электронов. От взаимного расположения валентной зоны и зоны проводимости и их заполнения электронами зависят электрические, оптические и другие свойства твердых тел.
Металлы, полупроводники и диэлектрики
У диэлектриков самая верхняя зона – зона проводимости – при естественных температурах оказывается пустой, а валентная зона полностью заполненной. Эти зоны разделены достаточно широким промежутком запрещённых значений энергии E3 (рис.1.3). Преодолеть эту запрещённую зону при естественных температурах электроны не могут. Поэтому в диэлектриках отсутствуют свободные носители заряда, способные переносить электрический ток.

а) б)
Рис. 1.3. Зонные диаграммы полупроводников и диэлектриков (а) и металлов (б)
Полупроводники имеют такую же зонную диаграмму, как и диэлектрики, но с меньшим энергетическим промежутком E3. Тогда при T=0 К в полупроводниках также нет свободных носителей заряда, способных переносить электрический ток. Но с повышением температуры некоторая часть электронов валентной зоны может приобрести энергию, достаточную для перевода их в зону проводимости. В зоне проводимости появится некоторое количество электронов, а в валентной зоне часть энергетических уровней освободится. И в той, и другой зоне электроны приобретут возможность изменять свою энергию под действием сил электрического поля и участвовать в электропроводности. Таким образом, зонные диаграммы полупроводников и диэлектриков отличаются лишь шириной запрещённой зоны E3. Принято материалы с E3>3 эВ относить к диэлектрикам, а материалы с E3 <3 эВ – к полупроводникам. При температуре 300 К у кремния E3=1.12 эВ, у германия E3=0.66 эВ, у арсенида галлия E3=1.43 эВ. У металлов сближение атомов на равновесное состояние приводит к перекрытию заполненной и свободной зоны. В результате образуется единая, частично заполненная зона (рис.1.3.). В такой зоне при любых температурах имеется достаточное количество заполненных и незаполненных уровней, что определяет хорошую электропроводность металлов. Обычно при рассмотрении электропроводности в полупроводниках используют упрощенные зонные диаграммы - рис.1.4, где Ec – дно зоны проводимости, Ev – потолок валентной зоны.

Рис.1.4. Упрощенная зонная диаграмма полупроводника
В реальных полупроводниковых материалах концентрация участвующих в электропроводности носителей заряда относительно мала и все носители размещаются у краёв зон.
Ковалентная связь между атомами полупроводниковых материалов
Атомы в твёрдых телах связаны между собой силами химической связи, которые обусловлены взаимодействием внешних электронных оболочек атомов. Энергетически наиболее устойчивыми являются электронные структуры инертных газов. Атомы других элементов, вступая в химическое взаимодействие, стремятся приблизить свою электронную структуру к электронной структуре ближайшего в периодической таблице инертного газа. Для полупроводниковых материалов наиболее характерна ковалентная связь между атомами. При этом виде связи образование устойчивых электронных оболочек происходит путём объединения электронных орбит атома с соседними атомами.
Простейшим примером ковалентной связи является межатомная связь в молекуле водорода Н2. Как известно, каждый атом водорода состоит из протона и одного электрона. Электрон вокруг ядра вращается очень быстро, и можно считать, что заряд электрона диффузно распределен по сфере с центром в центре протона (рис. 1.5,а). Если сблизить два таких атома на достаточно малое расстояние, то между электронами возникает взаимодействие, которое проявляется в перестройке электронных орбит атомов. Электроны в равной степени начинают принадлежать обоим атомам, и их движение происходит по общей орбите вокруг обоих ядер. В результате электронная плотность между протонами оказывается повышенной, между ними как бы появляется добавочный отрицательный заряд, который и связывает протоны вместе (рис. 1.5,б). Молекула Н2 имеет устойчивую электронную структуру, похожую на электронную структуру инертного газа гелия. Рассмотренный вид химической связи называют ковалентной или парноэлектронной связью. Аналогичный по характеру механизм образования ковалентной связи наблюдается в кристаллах наиболее распространенных полупроводниковых материалов, к которым относится германий(Ge) и кремний (Si).
Р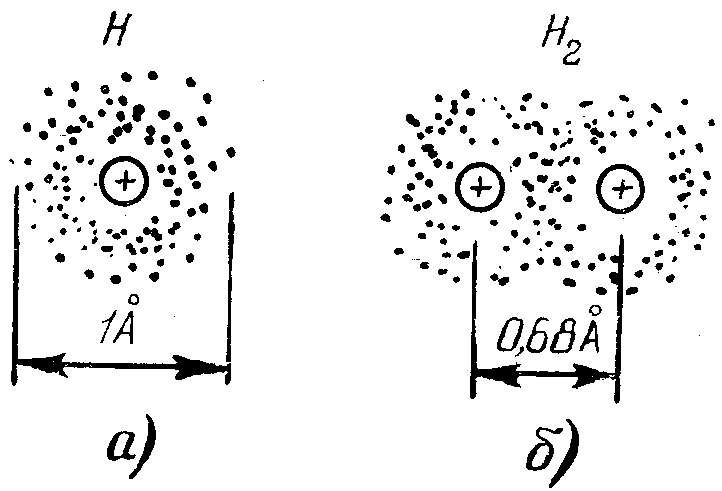 ис.
1.5. Ковалентная связь в молекуле водорода:
а — изолированный атом водорода; б —
молекула водорода
ис.
1.5. Ковалентная связь в молекуле водорода:
а — изолированный атом водорода; б —
молекула водорода
Ge и Si — четырехвалентные полупроводники. Это обусловлено тем, что их внешняя электронная оболочка содержит четыре электрона, а для полного ее заполнения требуется еще четыре электрона. Поэтому в кристаллах Ge и Si каждый атом объединяет свою внешнюю электронную оболочку с четырьмя ближайшими соседними атомами таким образом, что каждые два соседних атома имеют по два общих электрона, вращающихся вокруг обоих атомов. В результате каждый атом «в среднем» обладает устойчивой восьмиэлектронной оболочкой, хотя на каждый атом и приходится по четыре валентных электрона. Объединение электронных оболочек сопровождается перераспределением электронной плотности так, что она оказывается максимальной между ядрами, и так же, как в молекуле Н2, связывает их вместе (рис. 1.6, а). Ковалентная связь имеет направленный характер и обычно обусловливает правильную кристаллическую структуру полупроводникового материала, в которой атомы располагаются на одинаковом расстоянии друг от друга. Часто используется упрощенная модель кристаллической структуры полупроводника в виде, показанном на рис. 1.6, б.
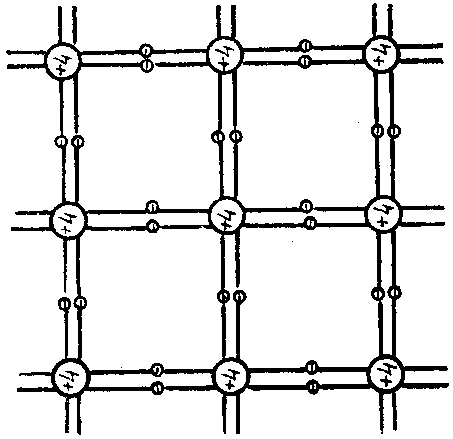
 Электронная
структура
германия и кремния - а) и
упрощенная двухмерная
модель кристаллической
структуры полупроводника
– б)
Электронная
структура
германия и кремния - а) и
упрощенная двухмерная
модель кристаллической
структуры полупроводника
– б)
