
- •I. Основы экологии
- •I.1. Глобальные экологические проблемы и условия перехода к устойчивому развитию
- •Контрольные вопросы к первому учебному модулю
- •Задачи к первому учебному модулю
- •I.2. Основные законы и понятия экологии
- •Контрольные вопросы ко второму учебному модулю
- •Задачи ко второму учебному модулю
- •I.3. Экологические основы рационального природопользования
- •Контрольные вопросы к третьему учебному модулю
- •Задачи к третьему учебному модулю
- •Литература.
- •II. Химия окружающей среды
- •II.1 химия атмосферы
- •II.1.1. Строение и состав атмосферы
- •II.1.2. Азот и сера в атмосфере
- •II.1.3. Фотохимический смог
- •II.1.4. Озоновый слой
- •II.1.5. Дисперсные системы в атмосфере
- •II.1.6. Трансграничный перенос загрязняющих атмосферу веществ
- •К онтрольные вопросы к первому учебному модулю
- •Задачи к первому учебному модулю
- •II.2. Химия гидросферы
- •Контрольные вопросы ко второму учебному модулю
- •Задачи ко второму учебному модулю
- •II.3. Химия литосферы
- •Контрольные вопросы к третьему учебному модулю
- •Задачи к третьему учебному модулю
- •II.4. Влияние деятельности человека на состав и свойства геосфер
- •Контрольные вопросы к четвертому учебному модулю
- •Задачи к четвертому учебному модулю
- •Литература.
II.3. Химия литосферы
(содержание III учебного модуля)
Строение и состав литосферы. Минералы и горные породы. Процессы выветривания и почвообразования. Почва. Функции почвы. Фазовый и элементный состав почв. Гумус. Состав и свойства гумусовых веществ. Почвенные растворы. Ионообменная способность почв. Селективность катионного обмена. Виды почвенной кислотности : актуальная и потенциальная кислотность. Распространение кислых почв и их продуктивность. Карбонатные системы в почвах, проблема щелочности. Формы соединений алюминия в почвах. Соединения кремния и алюмосиликаты. Азот, фосфор и сера в почвенных процессах. Марганец и железо в почвах. Микроэлементы и химическое загрязнение почв. Основные процессы саморегуляции в литосфере.
КРАТКОЕ ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ К III УЧЕБНОМУ МОДУЛЮ
Процентное содержание элемента в земной коре называется Кларком. В земной коре преобладают следующие элементы: O, Si, Al, Fe, Ge, Na, K, Mg, H, Ti, C, Cl, Ca (в сумме 99,2 %).
Элементы в земной коре присутствуют не в элементарном виде, а виде минералов. Последние существуют в виде комплексных агрегатов, иначе горных пород. Процессы разрушения минералов под воздействием абиотических и биотических факторов называются выветриванием. Существуют 3 формы выветривания: механическое, химическое и биологическое. Химическое выветривание характеризуется способностью к водной миграции компонента горной породы i:
Ki = 100mi/(ani),
где Ki - коэффициент водной миграции, mi - концентрация элемента в растворе (мг/л),
a - минерализация воды (мг/л), ni - концентрация элемента в породе (кларк).
Очевидно, что различные элементы обладают разной способностью к миграции, поэтому вводят ряды миграции:
1) элементы с сильной мигрирующей способностью, Ki = n10 - n100
(S, Cl, B, Br, I), где n - целое число;
2) элементы с сильной мигрирующей способностью, Ki = n - 10n
(Ca, Na, Mg, F, Sr, Zn, Mo, Se, Au);
3) элементы со средней мигрирующей способностью, Ki = 0,1n -n
(Si, K, Mn, P, Ba, Rb, Ni, As, Cs, Cu);
элементы со слабой мигрирующей способностью, Ki 0,01n
(Al, Fe, Ti, Th).
Биологическое выветривание - один из главных процессов, ведущих к почвообразованию. Почва представляет собой многокомпонентную систему, состоящую из 3 частей:
а) твердая часть, на которую приходится 40-65 % объёма;
б) почвенный раствор, до 35 % по объему;
в) почвенный воздух.
О потенциальном плодородии почв можно судить по элементному составу последних. Плодородные почвы содержат до 95 % неорганических соединений и 5 % органических веществ.
Гумус - это совокупность всех органических соединений находящихся в почве, но не входящих в состав живых организмов или их образований. В составе гумуса различают:
1) специфические гумусовые вещества (собственно гумусовые вещества);
2) неспецифические органические соединения;
3) промежуточные продукты распада и гумификации.
Содержание гумуса в почвах - основной показатель их продуктивности. Катионообменная способность почв относится к числу фундаментальных свойств почвы. Катионный обмен - частный случай ионного обмена, под которым понимают обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Формально реакцию обмена можно записать:
ППК(M1n+)m + nM2m+ ППК(M2m+)n + mM1n+,
где ППК- почвенно-поглощающий комплекс. Материальным носителем катионообменной способности почв является ППК. Почвенно-поглощающий комплекс (ППК) - это совокупность минеральных, органических и органоминеральных компонентов твердой части почвы, обладающих ионообменной способностью. Для конкретных катионов реакции обмена можно записать:
ППК(Са2+) + 2Na+ ППК(Na+)2 + Ca2+,
ППК(Al3+)2 + 3 Ca2+ ППК(Ca2+ )3 + 2 Al3+.
Не все твердые фазы почв способны проявлять катионообменную способность. Практически ей не обладают такие минералы, как кварц, очень слабо проявляется это свойство в любых фракциях почв, крупнее 2-5 мкм. Главным образом способность к катионному обмену сосредоточена в илистой фракции почв.
Одной из основных характеристик ППК и почвы в целом является емкость катионного обмена (ЕКО). Емкость катионного обмена - это общее количество катионов одного рода, удерживаемых почвой в обменном состоянии при стандартных условиях и способных к обмену на катионы взаимодействующего с почвой раствора. Величину ЕКО выражают в мг-экв/100 г почвы или ее
фракции. Величина ЕКО зависит от рН почвы, механического состава почвы и строения веществ, входящих в состав ППК. Величина ЕКО составляющих почву веществ колеблется в широких пределах, а именно практически от 0 (обломки кварца) до 500-900 мг-экв/100 г для гумусовых кислот.
Количественное соотношение между двумя любыми обменными катионами в ППК не равно отношению активностей (или концентраций) тех же катионов в равновесном растворе, что для реакции обмена:
ППК(Ca2+) + Mg2+ ППК(Mg2+) + Ca2+
можно выразить неравенством:
[Ca2+ППК]/[Mg2+ППК ] a(Ca2+)/a(Mg2+),
где индекс ППК означает катионы в составе ППК;
a(Ca2+), a(Mg2+) - активности катионов в равновесном растворе.
Это означает, что при равной активности катионов раствора один из них поглощается почвой в больших количествах и удерживается почвой более прочно. Иначе, почвы обладают способностью селективно (избирательно) поглощать катионы одного сорта в ущерб катионам другого сорта, что выражается уравнением:
[Ca2+ППК]/[Mg2+ППК ] = kc a(Ca2+)/a(Mg2+),
где kc - коэффициент селективности, показывающий характер распределения катионов между твердой частью почвы (ППК) и почвенным раствором.
Одна из главных функций ППК с точки зрения химии почв - участие его в обменных реакциях с загрязняющими веществами, поступающими в почву. Реакции обмена протекают в эквивалентных количествах и обратимы, если не сопровождаются хемосорбцией. Скорость и соотношение обменивающихся ионов зависят от их валентности в растворе, радиуса и концентрации. С повышением рН увеличивается поглощение таких катионов, как Cd, Pb, Zn, Hg и некоторых других; уменьшение рН ведет к большему поглощению As, Se, Sb, Mo. Как правило, при одном и том же содержании в почвах тяжелых металлов признаки угнетения растений в наибольшей степени проявляются в тех почвах, где ППК имеет мало активных центров, способных к реакциям ионного обмена с металлами, то есть где низка ЕКО. Почвы с ЕКО < 20 мг-экв/100 г наиболее подвержены загрязнению тяжелыми металлами и пестицидами; при ЕКО 50 мг-экв/100 г более устойчивы к загрязнению.
Кислотность почв проявляется в разных формах и вызывается различными элементами и соединениями. Различают 2 формы или вида почвенной кислотности:
- актуальная кислотность;
- потенциальная кислотность.
Потенциальная кислотность подразделяется на обменную и гидролитическую.
Актуальная кислотность - это кислотность почвенного раствора, обусловленная растворенными в нем соединениями. Степень кислотности почвенного раствора, водных вытяжек и водных суспензий оценивают
величиной рН. Кислотность почвенных растворов обусловлена присутствием свободных органических кислот; органических соединений, содержащих кислые функциональные группы; свободных минеральных кислот, а также элементов, проявляющих амфотерные свойства.
Величины рН водных вытяжек или суспензий не всегда совпадают со значениями рН почвенных растворов из-за разбавления почвенного раствора при приготовлении вытяжки и из-за влияния твердой фазы. Поэтому, в качестве показателя степени кислотности используют отношение активностей ионов водорода и тех катионов, которые преобладают в ППК и наиболее сильно влияют на реакции диссоциации и обмена катионов водорода. Реакция обмена Н+ и Са2+ записывается:
ППК(H+) + 0,5 Ca2+ ППК(Ca2+)0,5 + H+.
При равновесии:
[ H+]ППК/[Ca2+0,5]ППК
= kca(H+)/a(Ca2+).
H+]ППК/[Ca2+0,5]ППК
= kca(H+)/a(Ca2+).
С учетом влияния Mg2+ правая часть уравнения имеет вид:
 a(H+)/a(Ca2+)
+ a(Mg2+),
a(H+)/a(Ca2+)
+ a(Mg2+),
или в логарифмической форме:
lga(H+) - {lg[a(Ca2+) + a(Mg2+)]}1/2 = pH - 0.5{lg[a(Ca2+) + a(Mg2+)]}.
Вычисляемая по этой формуле величина получила название известкового потенциала почвы. Эту величину, как и другие аналогичные показатели можно использовать для характеристики равновесной системы: твердые фазы почвы - почвенный раствор.
Потенциальная кислотность проявляется в результате взаимодействия почвы с растворами солей или оснований. Она влияет и на уровень актуальной кислотности, но точные функциональные зависимости, позволяющие по потенциальной кислотности вычислять актуальную кислотность, не установлены.
Обменную кислотность определяют путем вытеснения ионов Н+ и Al3+ из ППК нейтральным раствором нейтральной соли (обычно 1-н раствор КCl):
ППК(Н+) + KCl ППК(К+) + HCl,
ППК(Al3+) + 3 KCl ППК(К3+) + AlCl3.
Степень кислотности оценивается по величине рН солевой вытяжки (1 н раствор KCl) или суспензии. Для этого солевую вытяжку титруют раствором щелочи:
HCl + NaOH NaCl + H2O,
AlCl3 + 3 NaOH 3 NaCl + Al(OH)3.
Напомним, что вытесненный из ППК ион Al3+ влияет не только на количество кислотности, но и на степень кислотности, так как в водных растворах он образует Al(OH)3, Al(OH)2+, и гидрооксокомплексы:
[Al(H2O)6]3+ + H2O [Al(H2O)5OH]2+ + H3O+.
Гидролитическую кислотность определяют путем взаимодействия почвы с гидролитически щелочной солью (1- н раствор CH3COONa). При этом происходят аналогичные реакции:
ППК(Н+) + CH3COONa ППК(Na+) + CH3COOH.
Таким образом, в общем виде обменную кислотность можно выразить:
Al3+
ППК + 4 KCl ППКК+4 + АlCl3 + HCl,
H+
а гидролитическую:
Al3+
ППК + 4 CH3COONa + 3 H2O ППКNa+4 + Аl(OH)3 + 4 CH3COOH.
H+
Обменная кислотность - это часть гидролитической кислотности почв. Её используют при определении дозы извести для устранения избыточной кислотности почв, а также для вычисления показателя, получившего название степень насыщенности почвы основаниями (V) и вычисляемого в % по формуле:
V = 100S/(S + Hg) или V = 100S/ЕКО,
где S - сумма поглощенных оснований, Hg - гидролитическая кислотность. Из формулы видно, что ЕКО складывается из суммы поглощенных оснований и гидролитической кислотности.
Для снижения почвенной кислотности в качестве химических мелиорантов применяют различные материалы, но наиболее употребительны осадочные породы, состоящие преимущественно из кальцита CaCO3 и доломита CaMg(CO3)2. С химической точки зрения CaCO3 является лучшим средством для снижения почвенной кислотности:
ППК(Н+)2 + CaCO3 ППК(Ca2+) + H2CO3 (CO2 и Н2О), или
ППК(Al3+)2 + 3 CaCO3 + 3 H2O ППК(Ca2+)3 + 2 Al(OH)3 + 3 CO2.
Обычно количество извести, которое необходимо для доведения реакции почв до требуемого уровня, определяют по кривым буферности почв (рис. 2.3). Так как под буферностью почвы понимают способность жидкой и твердой фаз почвы противостоять изменению реакции среды (рН) при взаимодействии почвы с кислотой или щелочью, то кривая буферности строится в координатах: рН - количество добавленной кислоты (щелочи).
р Н
Н

 10
10
8
 6
6
4
2
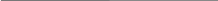



 12 9 6 3 0 3 6 9 12
12 9 6 3 0 3 6 9 12
0,1-н HCl, мл/100 г 0,1-н NaOH, мл/100 г
Рис. 2.3. Кривая буферности почв.
Напротив, при засолении почв и образовании солонцов (солонцовых почв) в целях мелиорации применяют гипсование почв. При растворении гипса в почвенный раствор поступает Ca2+, который замещает Na+ в почвенном поглощающем комплексе, в результате чего улучшаются химические и физические свойства почв. Дозу гипса (D) рассчитывают по формуле:
D = 0,086(m - 0,05T) Ed,
где m - содержание обменного Na+ (мг-экв/100 г почвы), E - емкость поглощения катионов = S + Hg , H - мощность мелиорируемой толщи (см), d - объемная масса почвы (г/см3).
Степень засоленности почв устанавливается по общему содержанию солей в водной вытяжке с учетом их видового состава.
Таблица 2.8
Классификация почв по степени засоления по величине плотного (сухого) остатка в водной вытяжке (%).
Уровень |
Тип засоления и сухой остаток водной вытяжки, % |
|||||||
засоления почв |
хлоридно-содо-вый |
сульфатно-содо-вый |
содово-хлоридный |
содово-сульфатный |
сульфатно-хлоридный |
хлоридно-сульфатный |
хлоридный |
сульфатный |
Практически не засоленная |
< 0,15 |
0,15 |
< 0,15 |
< 0,15 |
0,2 |
< 0,25 |
0,15 |
0,3 |
Слабозасоленная |
0,15-0,25 |
0,15-0,3 |
0,15-0,25 |
0,15-0,25 |
0,2-0,3 |
0,25-0,4 |
0,15-0,3 |
0,3-0,6 |
Среднезасоленная |
0,25-0,4 |
0,3-0,5 |
0,25-0,4 |
0,3-0,5 |
0,3-0,6 |
0,4-0,7 |
0,3-0,5 |
0,6-1,0 |
Сильнозасоленная |
0,4-0,6 |
0,5-0,7 |
0,4-0,6 |
0,5-0,7 |
0,6-1,0 |
0,7-1,2 |
0,5-0,8 |
1,0-2,0 |
Солончаки |
> 0,6 |
> 0,7 |
> 0,6 |
> 0,7 |
> 1,0 |
> 1,2 |
> 0,8 |
> 2,0 |
Таблица 2.9
Качественный состав засоления почв в зависимости от содержания анионов и катионов (мгэкв).
Вид засоления |
Соотношение анионов |
Вид засоления |
Соотношение катионов |
||
|
[Cl-]/[SO42-] |
[HCO3-]/ ([Cl-]+[SO42-] |
|
([Na+]+[K+])/([Ca2+]+[Mg2+]) |
[Ca2+]/ [Mg2+] |
Хлоридный |
> 2 |
- |
Натриевый |
> 2 |
- |
Сульфатно-хлоридный |
2 - 1 |
- |
Магниево-натриевый |
2 - 1 |
> 1 |
Хлоридно-сульфатный |
1 - 0,2 |
- |
Кальциево-натриевый |
1- 2 |
< 1 |
Сульфатный |
< 0,2 |
- |
Кальциево-магниевый |
< 1 |
> 1 |
Карбонатно-сульфатный |
< 0,2 |
> 1 |
Магниево-кальциевый |
< 1 |
> 1 |
Сульфатно-содовый |
- |
> 2 |
|
|
|
Особое место в химии почв занимают соединения тех элементов, которые присутствуют в почвах в микроколичествах, так они играют важную роль в биологических процессах. Это так называемые микроэлементы. В малых концентрациях (то есть когда их концентрации находятся в пределах толерантности) они необходимы для нормального развития организмов, но в повышенных количествах (больше верхнего предела толерантности) оказывают на них токсичное действие. Более того, в соответствии с законом минимума Либиха (вернее следствиями из него), повышенное содержание микроэлементов способно не только угнетающе действовать на развитие растений, но аккумулироваться в них, что ведет к последующему ухудшению качества продуктов питания (типичный пример такого явления - повышенное содержание нитратов в почвах и, как следствие, в продуктах питания). Интенсивность биологического поглощения элементов можно характеризовать формулой Перельмана:
КБП = li/ni,
где КБП - коэффициент биологического поглощения, li, ni - содержание элемента "i" соответственно в золе растений и горной породе или почве, на которой произрастает растение (кларк). По величине КБП А.И. Перельман и Б.Б. Полынов выделили 5 групп элементов, имеющих следующие коэффициенты поглощения:
1) энергично накопляемые (КБП = 10-100);
2) сильно накопляемые (КБП = 1-10);
3) слабого накопления и среднего захвата (КПБ = 0,1-1);
4) слабого захвата (КБП = 0,01-0,1);
очень слабого захвата (КБП = 0,001-0,01).
