
- •Предмет и задачи химии
- •3. История возникновения атомно-молекулярного учения Понятия атом , молекула химический элемент , изотоп
- •4.Дайте определение понятий простое вещество , аллотропия сложное вещество , химический элемент, изотоп
- •5. Относительная и абсолютная атомная масса , относительная молекулярная масса количество моль
- •15 Бора
- •16 Принцип неопределенности Гейзенберга
- •17 Уравнение шредингера понятие атомной орбитали
- •18 Четыри квантовых числа
- •19 Принцип заполнения атомных орбиталей
- •20 Современное представление о строение атома
- •21 Переодический закон
- •22 Переодическая таблица период группа
- •23 Потенциал ионизации энергия сродства к электрону Электрону
- •24 Теория химического строения Бутлерова
- •25 Классификация химических связей
- •31 Основные положения теории гибридизации
- •3 2 Основные положения метода молекулярных орбиталей достоинства и не достатки
- •33 Водородная связь
20 Современное представление о строение атома
Современное представление о строении атома – в настоящее время открыто более 350 элементарных частиц, не удается расщепить на основные части.
Кваврки – элементарные частицы из которых состоят нейтроны и протоны.
21 Переодический закон
Периодический закон – 1) физические и химические свойства простых веществ, а так же формы и свойства других соединений находятся в периодической зависимости от величины заряда ядра атома.
2) свойства элементов, а по тому и свойства образуемых ими простых и сложных тел состоят в периодической зависимости от их атомного веса.
22 Переодическая таблица период группа
Периодическая таблица – графическое изображение периодического закона.
Период – горизонтальный ряд элементов размещенных в порядке возрастания заряда ядра имеющих одинаковое число электронных слоев. Металлические свойства ослабевают, а неметаллические усиливаются.
Группа – вертикальные столбцы элементов с одинаковым числом валентных электронов равным номеру группы. Элементы одной группы проявляют одинаковые свойства – электронные аналоги.
В группе(главных) заполняются S и P подуровни; в группе(побочной) подуровень D.
В главных подгруппах металлические свойства усиливаются, неметаллические ослабевают.
23 Потенциал ионизации энергия сродства к электрону Электрону
Потенциал ионизации – мера подвижности электрона в атоме, количество энергии которую необходимо потратить, чтобы оторвать электрон от атома или иона.
Энергия сродства к электрону – энергия которая выделяется при присоединении электрона к атому.
Электроотрицательность – способность атома связанного с другим атомом перетягивающего на себя электронное облако, вызывая тем самым поляризацию связи.
Валентность – способность атомов образовывать химические связи. Наиболее подвижные электроны – валентные(за счет их образуются связи)
24 Теория химического строения Бутлерова
Теория химического строения Бутлерова:
Атомы в молекулах соединены друг с другом в определенной последовательности, изменение которой приводит к образованию нового вещества.
Соединения атомов происходит в соответствии с их валентностью.
Свойства веществ зависят не только от состава, но и от порядка соединений атома и характера их взаимного влияния.
25 Классификация химических связей
Классификация химических связей:
В зависимости от расстояния:
Короткодействующая связь
Дальнодействующая
В зависимости от перераспределения электронной плотности между атомами:
Неполярная(ковалентная)
Полярная(ковалентная)
Сильнополярная(ионная)
В зависимости от степени обобществления электронной плотности между несколькими атомами:
Локализированная
Делокализированная
26 Ковалентная химическая связь
Ковалентная химическая связь возникает за счет обобществления электронной пары
Обменный механизм
Донорно-акцепторный
Дативные связи
Неполярная ковалентная связь возникает если молекула образованна атомами с одинаковой электроотрицательностью.
Полярная ковалентная связь возникает если молекула образованна атомами с разной электроотрицательностью.
27 Ионная химическая связь
Ионная химическая связь образованна за счет электростатического напряжения между катионами и анионами.
Отличительные черты:
Не направленность
Не насыщаемость
28 Металлическая связь
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые свободно движутся в решётке металлов, электростатически взаимодействуя с ионами металла.
29 Основные положения метода валентных связей
Основные положения метода валентных связей:
Химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей с образованием электронных пар.
Атомы обмениваются электронами, которые образуют связывающие пары, энергия обмена электронами между атомами вносит основной вклад в образование химической связи.
По принципу Паули связь образуется только между электронами с разными спинами.
Характеристика химической связи определяется типом перекрывания атомных орбиталей.
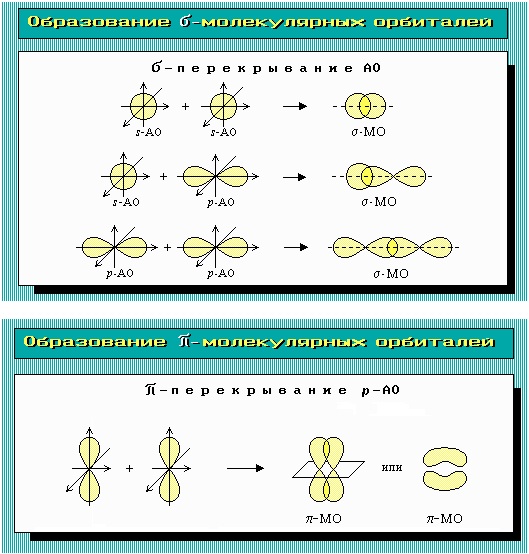 30 Типы
перекрывания атомных орбиталей
30 Типы
перекрывания атомных орбиталей
Типы перекрывания атомных орбиталей
Дельта связь: после образования сигма и пи связей между атомами у которых есть d и f орбитали, может образовываться дельта связь – путем перекрывания лепестков орбиталей сразу в 4 местах.
