
- •1.Предмет термодинамики, её методы, задачи. Основные понятия и определения. Термодинамическая система. Виды термодинамических систем.
- •2.Параметры состояния. Уравнения состояния. Термодинамический процесс. Равновесные и неравновесные, обратимые и необратимые процессы.
- •3.Идеальный газ. Уравнение состояния идеального газа. Термическое и калорические параметры состояния идеального газа.
- •Уравнения состояния идеального газа
- •1) Закон Бойля-Мариота
- •2) Закон Гей-Люсака
- •4.Газовые смеси, способы задания, вычисление параметров состояния, кажущейся молекулярной массы и газовой постоянной смеси, определение парциальных давлений, закон Дальтона.
- •5.Теплоемкость газов. Классификация теплоемкостей. Уравнение Майера. Истинная и средняя теплоемкости газа. Теплоемкость смеси идеальных газов.
- •6.Полная энергия тела(системы), внутренняя энергия, энтальпия, энтропия и их свойства.
- •7.Теплота и работа. Выражение теплоты и работы через термодинамические параметры состояния.
- •8.Первое начало термодинамики. Сущность первого закона термодинамики, формулировки, аналитическое выражение.
- •9.Термодинамические процессы идеальных газов
- •10.Политропные процессы. Определение, уравнение, формулы расчета...
- •4.3. Политропный процесс.
- •11.Прямые и обратные циклы. Условия работы тепловых машин. Термический кпд и холодильный коэффициент.
- •12.Цикл и теоремы Карно.
- •15.Свойства реальных газов. Уравнения состояния реального газа.
- •13.Второй закон термодинамики.
7.Теплота и работа. Выражение теплоты и работы через термодинамические параметры состояния.
В
т/д рассматривается 2 способа передачи
энергии: по средствам совершения работы
и передачи некоторого количества
теплоты. Работа L
и количество теплоты Qт
являются функциями процесса , т.е. их
значение будет зависеть от пути перехода
т.д. процесса. Элементарная работа
совершаемая газом определяется формулой:
δL=pdV.
Тогда L=
интеграл от V2
до V1
pdV.
Т.о. работа численно будет равна площади
под кривой процесса на pV-диаграмме.
Элементарное количество теплоты
определяется по формуле δQт=сmdT,
где с-удельная(массовая теплоемкость
тела,Дж/кг*К)![]() Qт=
интеграл (от Т2 до Т1) cmdT.
Также δQт=TdS,
где S-энтропия
т/д системы,Дж/К; Энтропия т.д. системы
является функцией состояния системы
и с точки зрения статистической физики
служит мерой порядка в системе. Согласно
формуле кол-во теплоты можно представить
в виде площади под графиком т.д. процесса
на Ts
диаграмме Единицей измерения работы
и кол.теплоты является 1 Дж.
Qт=
интеграл (от Т2 до Т1) cmdT.
Также δQт=TdS,
где S-энтропия
т/д системы,Дж/К; Энтропия т.д. системы
является функцией состояния системы
и с точки зрения статистической физики
служит мерой порядка в системе. Согласно
формуле кол-во теплоты можно представить
в виде площади под графиком т.д. процесса
на Ts
диаграмме Единицей измерения работы
и кол.теплоты является 1 Дж.![]()
Тела,
участвующие при протекании т/д процесса
обмениваются энергией. Передача энергии
от одного тела к другому происходит
двумя способами. 1-й
способ реализуется
при непосредственном контакте тел,
имеющих различную температуру, путем
обмена кинетической энергией между
молекулами соприкасающихся тел либо
лучистым переносом внутренней энергии
излучающих тел путем э/м волн. При этом
энергия передается от более нагретого
к менее нагретому. Количество энергии,
переданной 1-м способом от одного тела
к другому, называется количеством
теплоты –
Q [Дж], а способ – передача энергии в
форме
теплоты. 2-й
способ связан с наличием силовых полей
или внешнего давления. Для передачи
энергии этим способом тело должно либо
передвигаться в силовом поле, либо
изменять свой объем под действием
внешнего давления, То есть передачи
энергии происходит при условии
перемещения всего тела или его части
в пространстве. При этом количество
переданной энергии называется работой
–
 [
Дж], а способ передача энергии в форме
работы.
[
Дж], а способ передача энергии в форме
работы.
8.Первое начало термодинамики. Сущность первого закона термодинамики, формулировки, аналитическое выражение.
Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов. Этот закон является законом сохранения и превращения энергии: ¦"Энергия не исчезает и не возникает вновь, она лишь переходит ¦из одного вида в другой в различных физических процессах". Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии т/д системы: ¦"Теплота, подведенная к системе, расходутся на изменение энергии ¦системы и совершение работы". Уравнение первого закона термодинамики имеет следующий вид:
Q = (U2 – U1) + L , где Q - количества теплоты подведенная (отведенная) к системе; L - работа, совершенная системой (над системой); (U2– U1) - изменение внутренней энергии в данном процессе. Если: Q > 0 – теплота подводится к системе; Q < 0 – теплота отводится от системы; L > 0 –работа совершается системой; L < 0 – работа совершается над системой. Для единицы массы вещества уравнение первого закона термодинамики имеет вид: q = Q /m = (u2 – u1) + l .
1-й закон т/д указывает, что для получения полезной работы (L) в непрерывно действующем тепловом двигателе надо подводить (затрачивать) теплоту (Q). ¦"Двигатель, постоянно прозводящий работу и не потребляющий ¦никакой энергии называется вечным двигателем I рода." Из этого можно высказать следующее определение 1-го закона термодинамики:" Вечный двигатель первого рода невозможен".
Аналитическое выражение.

 ;
;
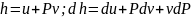





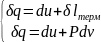 закрытая
система
закрытая
система
 открытая
систем
открытая
систем
