
- •Решения типовых задач и контрольные задания
- •Стехиометрические расчеты Примеры решения задач
- •Контрольные задания
- •Химическая термодинамика* Примеры решения задач
- •Контрольные задания
- •Химическая кинетика. Химическое равновесие Примеры решения задач
- •Контрольные задания
- •Концентрации растворов Примеры решения задач
- •Контрольные задания
- •5. Составление молекулярных и ионно-молекулярных уравнений реакций обмена
- •Примеры решения задач
- •Контрольные задания
- •6. Гидролиз солей Примеры решения задач
- •Контрольные вопросы
- •7. Окислительно-восстановительные реакции (овр) Примеры решения задач
- •Контрольные задания
- •8. Электродные потенциалы. Гальванические элементы Примеры решения задач
- •Контрольные задания
- •9. Электролиз Примеры решения задач
- •Контрольные задания
- •10. Коррозия Примеры решения задач
- •Контрольные задания
- •Варианты контрольных заданий
- •Приложения
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •2. Стандартные энтропии s0298 некоторых веществ при 298 к (25° с)
- •3. Стандартная энергия Гиббса образования некоторых веществ
- •4. Константы и степени диссоциации слабых электролитов
- •5. Величины стандартных электродных потенциалов
Решения типовых задач и контрольные задания
Стехиометрические расчеты Примеры решения задач
Пример 1. Для восстановления оксида ванадия массой 25,0 г до металла потребовалось кальция массой 27,5 г. Вычислите молярную массу эквивалентов оксида ванадия. Напишите уравнение реакции.
Решение. В общем виде формулу оксида ванадия представим как VхОг. Согласно закону эквивалентов: nэк(VxOy ) = nэк(Са), или
![]() (1)
(1)
где nэк(VxOy ) и nэк(Са) – количество моль эквивалентов соответственно оксида ванадия и кальция; m (VxOy ) и m (Са) – массы соответствующих веществ, г; Mэкв(VxOy ) и Mэкв(Са) – молярные массы эквивалентов, г/моль экв.
Из (1) получим:
![]()
где
![]() г/моль экв
г/моль экв
Молярная масса эквивалентов оксида ванадия
![]() г/моль экв.
г/моль экв.
Для написания уравнения реакции нужно знать формулу оксида ванадия, т. е. валентность ванадия в нем:
![]() (2)
(2)
где М(V) = 50,94 г/моль – молярная масса ванадия; Mэкв (V) – молярная масса эквивалентов ванадия, г/моль экв.
Молярная масса эквивалентов сложного вещества равна сумме молярных масс эквивалентов составляющих его частиц: Mэкв(VxOy) = Mэкв (V) + Mэкв (O). Отсюда Mэкв (V) = Mэкв(VxOy) – Mэкв (O) = 18,2 – 8,0 = 10,2 г/моль экв. Подставим это значение в выражение (2):
![]()
Формула данного оксида ванадия V2О5.
Уравнение реакции: V2О5 + 5Са = 2V + 5СаО
Пример 2. В водном растворе фосфат натрия Na3PО4 массой 77,5 г прореагировал без остатка с хлороводородной кислотой НСl массой 34,5 г. Вычислите молярную массу эквивалентов фосфата натрия. Напишите уравнение реакции.
Решение. Согласно закону эквивалентов
![]() или
или
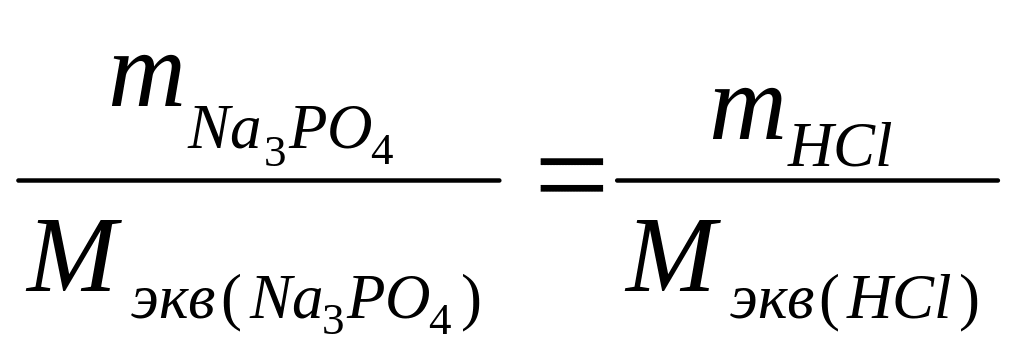
Отсюда
![]() г/моль экв,
г/моль экв,
где
![]() г/моль.
г/моль.
Молярная масса фосфата натрия:
М (Na3ро4) = 3 23,0 + 31,0 + 4 16,0 = 164,0 г/моль.
Число ионов водорода Н+, замещающих в молекуле Na3PО4 ионы натрия Na+, равно
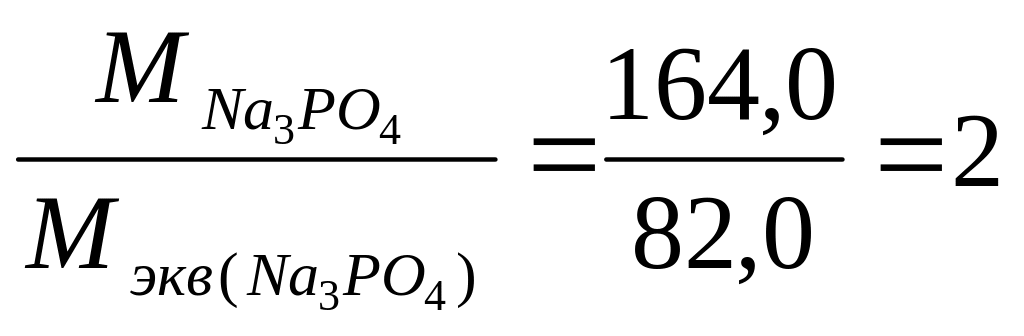
следовательно, уравнение реакции:
Na3PO4 + 2НС1 = NaH2PО4 + 2NaCl
Пример 3. Молярная масса эквивалентов хлорида некоторого элемента Мэкв(хл) равна 38,5 г/моль экв. Вычислите массовую долю хлора в хлориде (в %). Рассчитайте объем кислорода (н. у.), который потребуется для окисления до оксида простого вещества этого элемента массой 25,0 г. Определите, какой это элемент, если валентность его В = 4.
Решение. По закону эквивалентов
![]()
где индекс «хл» относится к характеристикам хлорида элемента;
Мэкв(Cl) = М(Cl) = 35,5 г/моль.
Если массу хлорида принять за 100 г, то масса хлора (mС1) будет равна массовой доле хлора в этом хлориде ( Cl, %). Тогда
![]()
Отсюда
![]()
Молярная масса эквивалентов искомого элемента равна
Mэкв = Мэкв (хл) – Мэкв (Cl) = 38,5– 35,5 = 3,0 г/моль экв.
Из закона эквивалентов следует
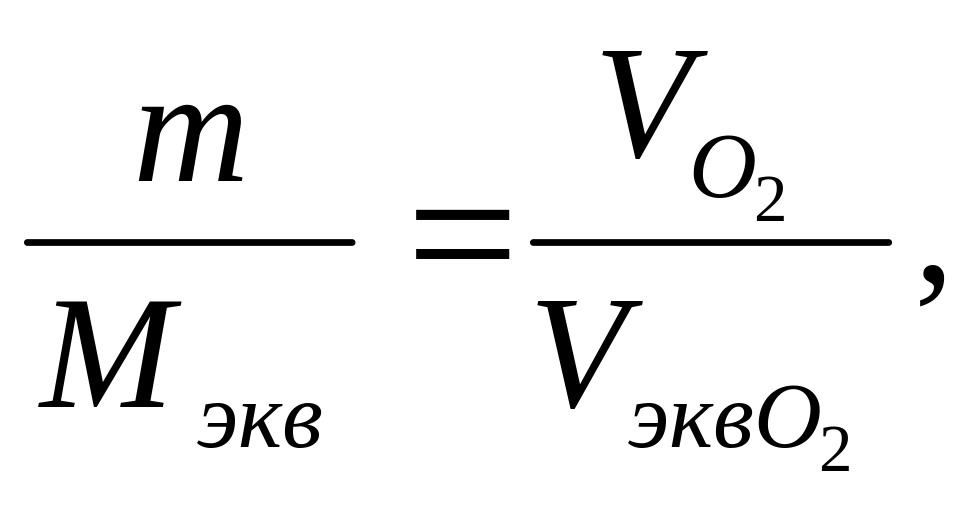 (3)
(3)
где т – масса простого вещества элемента, г; VO2 – объем кислорода (н. у.), необходимый для окисления этой массы, л; Vэкв O2 – объем молярной массы эквивалентов кислорода (н. у.), л/моль экв.
Поскольку 1 моль О2 (МО2 = 32,0 г/моль) занимает при н. у. объем 22,4 л/моль и имеет массу в 4 раза большую, чем 1 моль эквивалентов О2(Мэкв О2 = 8,0 г/моль экв), то Vэкв (о2)= 22,4/4 = 5,6 л/моль экв.
Из уравнения (3) получим
![]() л
л
Молярная масса элемента: М= МэквВ = 3,0 4 = 12,0 г/моль, что соответствует углероду. Хлорид СС14; оксид СО2.
Пример 4. Гидрид некоторого элемента в двухвалентном состоянии содержит 5,88 % водорода. Какова массовая доля (в %) этого элемента в его оксиде, где валентность элемента равна шести? Назовите этот элемент.
Решение. Из закона эквивалентов
![]()
В 100 г гидрида содержится mH = 5,88 г водорода и m1 = 100 – 5,88 = 94,12 г элемента. Молярная масса эквивалентов элемента в гидриде равна:
![]() г/моль экв
г/моль экв
Поскольку в гидриде элемент двухвалентен, молярная масса этого элемента
М = Мэкв(1) 2 = 16,0 2 = 32,0 г/моль.
В оксиде, где валентность элемента 6, молярная масса его эквивалентов равна
![]() г/моль экв
г/моль экв
Молярная масса эквивалентов кислорода Мж(О) = 16,0/2 = 8,00 г/моль экв.
Из закона эквивалентов:
![]()
Заменим массы на массовые доли в %:
![]()
После преобразований получим:
![]()
Элемент с молярной массой 32,0 г/моль является серой. Массовая доля серы в ее оксиде (SО3) равна 40,0 %. Гидрид серы – H2S.
