
- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
5.9. Закон распределения Нернста. Экстракция
Рассмотрим систему, состоящую из двух практически не растворимых друг в друге жидкостей. Если к такой системе добавить третью жидкость, которая растворима и в первом, и во втором растворителях, то распределение третьего компонента между двумя несмешивающимися жидкостями будет происходить в соответствии с законом распределения Нернста: «В равновесной гетерогенной системе, состоящей из двух нерастворимых или ограниченно растворимых жидкостей, отношение концентраций третьего компонента, распределяющегося между ними, есть величина постоянная, зависящая только от температуры»:
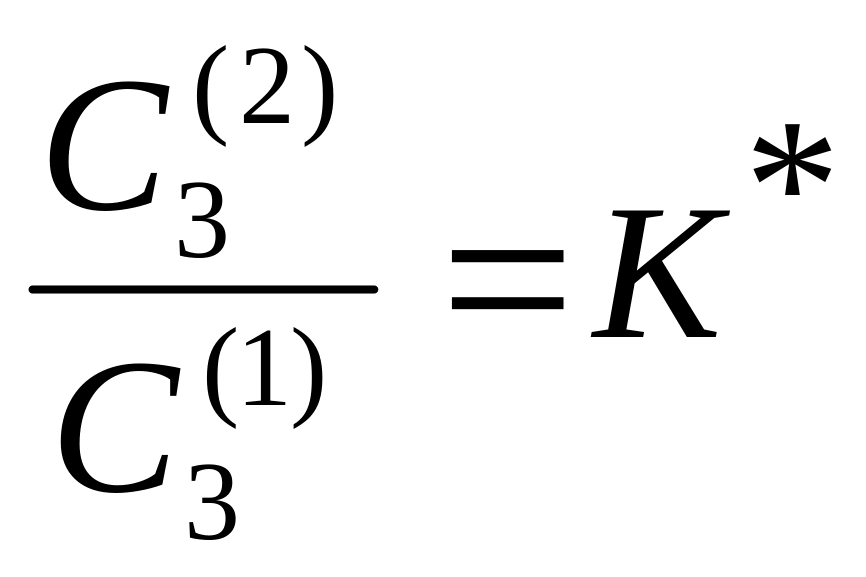 (5.52)
(5.52)
К* – коэффициент распределения, зависящий от природы веществ и от температуры. Закон распределения Нернста выполняется в виде уравнения (5.52) при условии отсутствия диссоциации и ассоциации молекул распределяющегося компонента и отсутствии его влияния на взаимную растворимость 1-го и 2-го растворителей. Например, при распределении янтарной кислоты С2Н4(СООН)2 между этиловым спиртом (2) и водой (1), она практически не диссоциирует в них и К*=5,38 при 298 К.
В общем случае:
![]() (5.53)
(5.53)
При ассоциации молекул растворенного
вещества n и m
меньше единицы, при диссоциации –
больше единицы. Так, например, при
распределении салициловой кислоты,
С6Н4(ОН)СООН, между водой
(1) и бензолом (2) при 298 К , происходит её
частичная диссоциация в воде, и закон
распределения для этой системы выразится
уравнением:
![]() .
.
Закон распределения можно обосновать теоретически, учитывая, что равновесие растворенного вещества в двух несмешивающихся растворителях характеризуется равенством его химических потенциалов в обеих фазах:
![]() , (5.54)
, (5.54)
откуда:
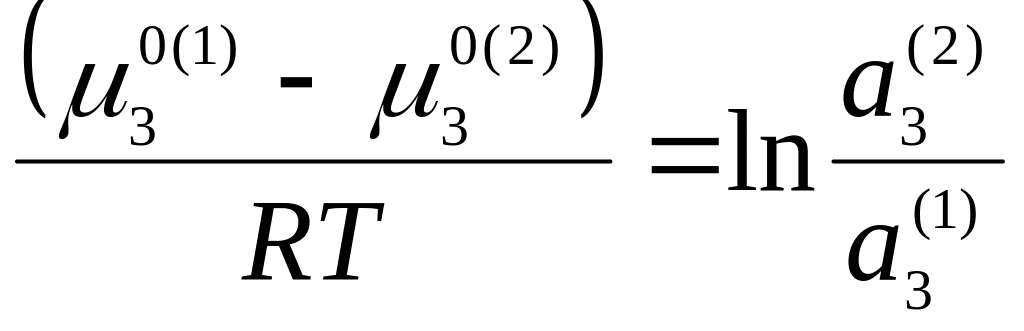 (5.55)
(5.55)
Так как стандартные химические потенциалы
веществ,
![]() ,
а также R и T
– постоянны, то и отношение активностей
компонента 3 в первом и втором растворителях
постоянно, т.е.
,
а также R и T
– постоянны, то и отношение активностей
компонента 3 в первом и втором растворителях
постоянно, т.е.
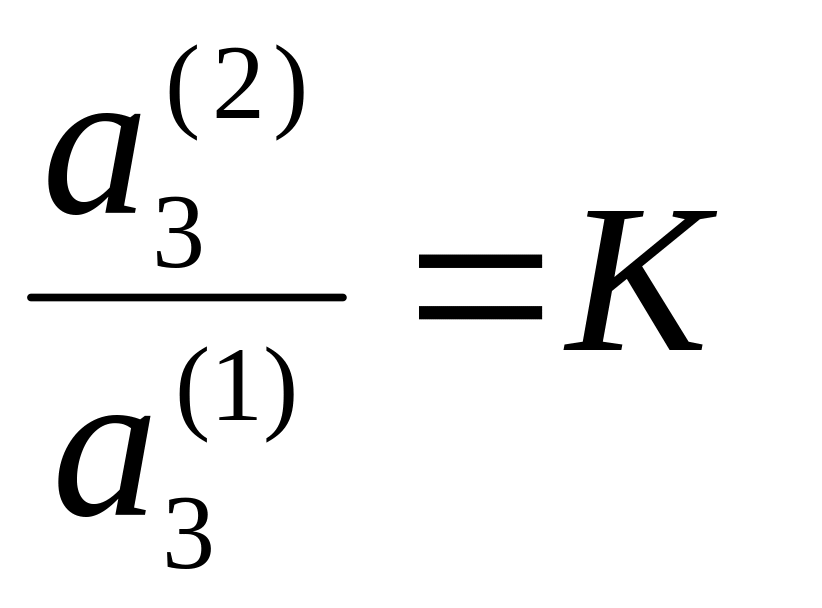 (5.56)
(5.56)
Выразим активности через коэффициенты активностей f и концентрации C:
 (5.57)
(5.57)
очевидно, что соотношение констант К и К* выражается уравнением:
 (5.58)
(5.58)
Строго говоря, формальный коэффициент распределения К* зависит от концентрации растворенного вещества в обоих растворителях, поскольку коэффициент активности f зависит от концентрации веществ. С разбавлением, когда f →1, К перестает зависеть от концентрации и становится равен К.
На законе распределения Нернста основан метод извлечения растворенного вещества из раствора при помощи второго растворителя.
Этот метод называется экстракцией. Рассмотрим некоторые закономерности процесса экстракции.
Представим себе раствор, состоящий из двух жидкостей: растворителя и растворенного вещества, общим объёмом V1 (объём экстрагируемого раствора). Допустим, необходимо извлечь растворённое вещество. Добавим к нему некоторый объём другого растворителя (экстрагента) V2, не смешиваемого с первым. Часть растворенного вещества перейдет во второй растворитель, т. е произойдет экстракция. При необходимости извлечения растворенного вещества, подбирают экстрагент, в котором данное вещество растворимо намного лучше, чем в исходном растворителе. По закону распределения, отношение равновесных концентраций растворенного вещества во втором и первом растворителях: К=С2/С1. Допустим, в первом растворителе после экстракции осталось количество растворенного вещества g1, а во второй растворитель перешло количество вещества go – g1. Тогда:
![]() , (5.59)
, (5.59)
где go – количество растворённого вещества в первом растворителе до экстракции. Количество вещества, оставшееся в первом растворителе после экстракции, найдем из уравнения 5.59:
![]() (5.60)
(5.60)
Для более полного извлечения вещества повторим экстракцию с новой порцией второго растворителя, добавив его к объёму раствора, оставшегося после первой экстракции. После повторной экстракции в исходном растворителе останется неизвлеченного вещества:
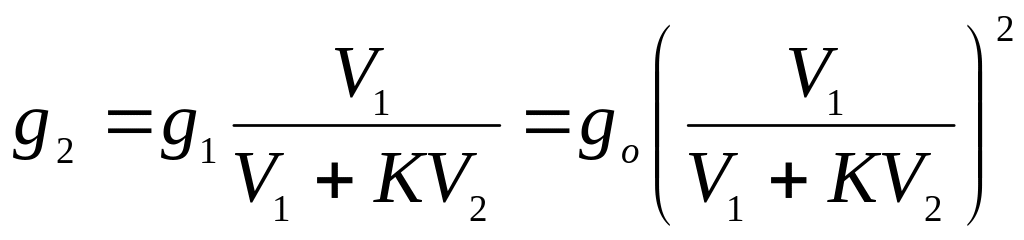 (5.61)
(5.61)
После «n» экстракций количество оставшегося в первом растворителе вещества будет
![]() (5.62)
(5.62)
Если экстракцию провести однократно, использовав сразу весь объём растворителя, nV2 , то количество оставшегося, неэкстрагированного вещества в первом растворителе будет
![]() (5.63)
(5.63)
Сравнение уравнений (5.62) и (5.63) показывает, что, поскольку степенная функция (5.63) убывает быстрее, чем линейная (5.64), очевидно, что количество оставшегося неизвлеченного вещества в первом растворителе будет гораздо больше при однократном использовании растворителя, g/ . Следовательно, более полное извлечение растворенного вещества достигается при многократной экстракции малыми порциями экстрагента.
