
- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
5.8. Взаимная растворимость жидкостей
По взаимной растворимости жидкости условно делят на 3 группы:
1) взаимно не растворимые (например, ртуть и вода);
2) неограниченно растворимые (например, вода и ацетон);
3) ограниченно растворимые (например, вода и анилин).
Рассмотрим системы с ограниченной взаимной растворимостью компонентов.
В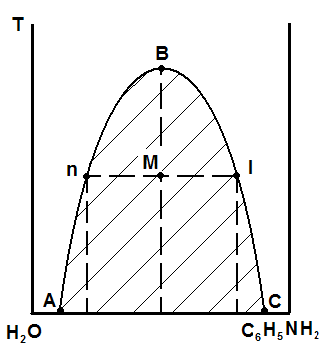 заимная
растворимость компонентов зависит от
температуры. Эта зависимость на диаграмме
состояния изображается в виде кривой
расслоения (рис. 5. 10).
заимная
растворимость компонентов зависит от
температуры. Эта зависимость на диаграмме
состояния изображается в виде кривой
расслоения (рис. 5. 10).
Рис. 5.10. Диаграмма состояния системы вода – анилин
Область ограниченной растворимости компонентов находится на рис. 5.10 под кривой расслоения АВС. В любой точке под кривой система гетерогенна и состоит из двух сопряженных растворов: раствор анилина в воде и раствор воды в анилине. Составы сопряженных фаз находят по кривой расслоения: кривая. АВ характеризует состав водного слоя в зависимости от температуры, а кривая ВС – анилинового.
С ростом температуры взаимная растворимость компонентов растет, и при температуре, соответствующей точке В (критическая точка), составы слоёв становятся одинаковы и они сливаются, образуя однофазную двухкомпонентную систему, состав которой характеризует проекция точки В на ось абсцисс. За пределами заштрихованной области расслоения система гомогенна, то есть представляет собой либо раствор анилина в воде, либо раствор воды в анилине, в зависимости от того, какой из компонентов преобладает в составе раствора (это растворитель), а какой находится в виде растворенного в нём вещества.
Составы сопряженных слоёв и их относительные количества можно найти по правилу рычага. Допустим, взято 5 кг смеси. Обозначим массу слоя «n» за х, тогда масса слоя «l» будет равна 5-х. По правилу рычага, х/(5-х) = Мl/Мn. Допустим, отношение отрезков составляет 0,8. Тогда х=(5-х)0,8 , откуда х=2,2 кг. Определив по диаграмме относительные содержания компонентов в каждом слое, (проекции точек n и l на ось состава), можно найти количество каждого компонента в анилиновом и водном слоях.
Существуют системы с нижней критической точкой расслоения, например, система вода – триэтиламин (кривая, ограничивающая область расслоения, проходит в этом случае через минимум), а также с двумя критическими точками: верхней и нижней (например, вода – никотин).
Существование верхней и или нижней критических температур расслоения находится в соответствии с принципом смещения равновесия Ле Шателье – Брауна. Если процесс взаимного растворения двух жидкостей сопровождается поглощением теплоты, то нагревание будет увеличивать взаимную растворимость. В этом случае будет существовать верхняя критическая точка. В экзотермическом процессе растворения картина будет противоположная: если процесс взаимного смешения жидкостей сопровождается выделением тепла, то понижение температуры будет повышать взаимную растворимость, и на кривой расслоения будет наблюдаться минимум. Существование двух критических точек расслоения говорит о том, что с изменением температуры происходит смена знака теплоты растворения.
Большое значение имеют вопросы взаимной растворимости жидкостей в образовании металлургических сплавов. Существуют металлы, взаимная растворимость которых в расплавленном состоянии очень мала. Например, практически не растворимы друг в друге расплавленные железо и свинец. При температуре выше 15270 ±50 они будут существовать в виде двух жидких слоев. При понижении температуры система будет представлять собой сначала твердое железо и расплавленный свинец, а затем, при температуре ниже 3270, когда будет достигнута температура кристаллизации свинца, образуется 2 слоя твердых фаз, состоящих из практически чистых металлов. Растворимость Fe в Pb в твердом состоянии равна 2·10-4 вес.%.
Явления расслаивания очень важны в геологии. Они проявляются, например, при образовании магматических пород. В основных и ультраосновных магмах при высоких концентрациях серы, меди, никеля и железа явления расслаивания вызывают кристаллизацию пирротина FeS, пентландита (Fe, Ni)9S8, пирита FeS2, халькопирита CuFeS2 и других минералов из сульфидного расплава. Это приводит, например, к формированию крупных медно – никелевых месторождений (Норильск, Талнах).
