
- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
5.7. Осмотическое давление
Осмосом называют самопроизвольное проникновение растворителя через полупроницаемую перегородку в раствор. Полупроницаемой перегородку называют потому, что через неё могут проходить только молекулы растворителя, а растворенного вещества – не могут. Сила, заставляющая молекулы растворителя переходить через полупроницаемую перегородку (мембрану), названа осмотическим давлением. Его можно иначе определить как давление, которое необходимо приложить, чтобы прекратить переход растворителя через мембрану. Впервые осмотическое давление было обнаружено Нолле, в 1748 году.
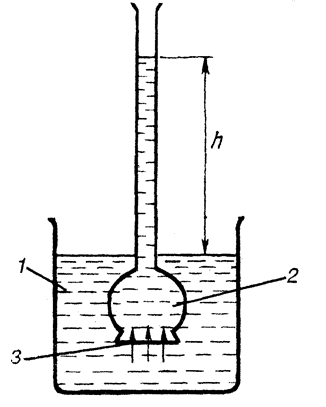
Простейший осмометр изображен на рис. 5.9. Сосуд 2 с водным раствором снизу закрыт мембраной и помещен в сосуд 1, наполненный водой. Вода вследствие осмоса проникает в сосуд 2. Гидростатическое давление столба жидкости в сосуде 2 уравновесит осмотическое давление и установится равновесие.
В 1887 году Вант-Гофф показал, что осмотическое давление π в разбавленных растворах выражается уравнением:
π = СRT (5.43)
Для идеальных растворов уравнение Вант-Гоффа можно получить, исходя из условия равенства химических потенциалов растворителя в растворе μ1 и в чистом растворителе μ01 .
Это равенство – есть условие установившегося равновесия в системе:
μ1(N1, π) = μ01 (5.44)
Возьмем полный дифференциал от обеих частей уравнения (5.44), учитывая, что химический потенциал чистого растворителя – постоянная величина.
Рис. 5.9. Осмометр
 (5.45)
(5.45)
Применяя полученные ранее уравнения для характеристических функций (2.61), с учетом тождества (2.68), можно записать:
 , (5.46)
, (5.46)
где
![]() - парциальный молярный объём растворителя.
- парциальный молярный объём растворителя.
Подставляя (5.46) в (5.45), получим уравнение, устанавливающее зависимость осмотического давления от состава раствора и химического потенциала растворителя:
![]() (5.47)
(5.47)
В идеальном растворе изменения
объёма компонента при образовании
раствора не происходит, поэтому
парциальный молярный объём растворителя
равен молярному объёму чистого
растворителя
![]() ,
а
,
а
![]() выражается
уравнением (2.75). С учетом этого из
(5.47) получим:
выражается
уравнением (2.75). С учетом этого из
(5.47) получим:
![]() (5.48)
(5.48)
В результате интегрирования уравнения
(5.48) в пределах от 0 до
![]() и
от 1 до N1, получим
уравнение, выражающее зависимость
осмотического давления идеального
раствора от состава:
и
от 1 до N1, получим
уравнение, выражающее зависимость
осмотического давления идеального
раствора от состава:
![]() (5.49)
(5.49)
Для предельно разбавленных растворов уравнение (5.49) тоже применимо. Учитывая, что
–lnN1 = - ln(1-N2) ≈ N2 , (5.50)
а молярный объём чистого растворителя равен молярному объёму раствора V, из (5.49) получим:
![]() или
или
![]() , (5.51)
, (5.51)
где С – концентрация раствора.
Осмотическое давление играет очень важную роль в процессах жизнедеятельности различных организмов. По закону осмоса происходит распределение различных веществ и воды в тканях человека и животных. Известно, что осмотическое давление крови человека составляет около 8 атм (8,1·105 Па). Недостаток воды в организме проявляется чувством жажды, а утоление её восстанавливает необходимое осмотическое давление крови и восстанавливает водно-солевой баланс. Осмотическое давление служит движущей силой для поглощения влаги прорастающими в почве семенами, благодаря чему, даже при невысокой окружающей влажности, «сосущая сила клетки» может достигать нескольких сотен атмосфер. На применении уравнения Вант-Гоффа основан один из методов определения молярной массы растворенного вещества в разбавленном растворе.
