
- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
Диаграммы «давление – состав» для реальных растворов без экстремума и с экстремумом изображены в верхнем ряду рис. 5.6. Первый закон Коновалова выполняется и для реальных растворов.
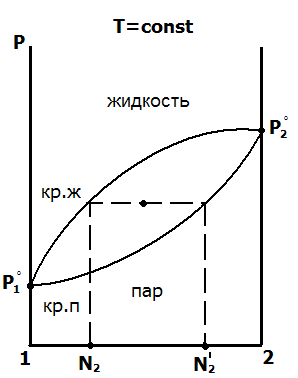
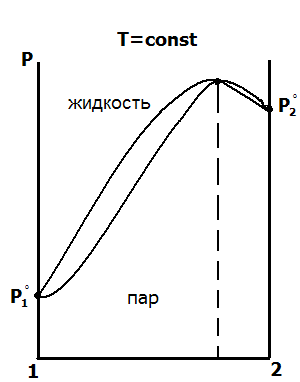
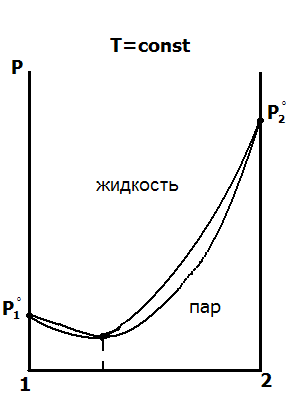
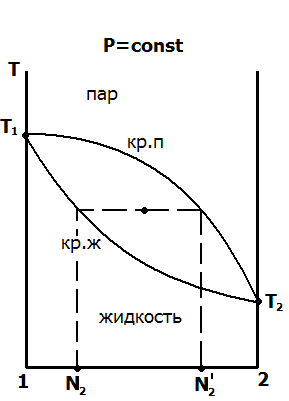
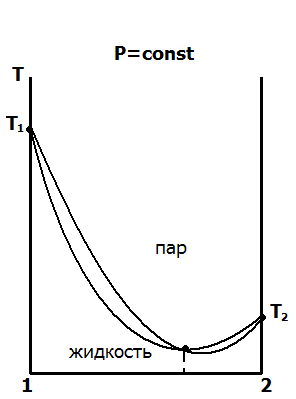
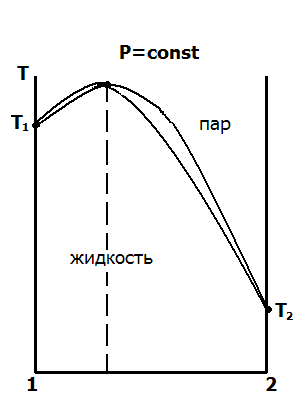
рис. 5.6. Диаграммы «давление – состав» и «температура – состав» для реальных (неидеальных) бинарных летучих жидкостей
Как видно из рисунков с экстремумами, в точках экстремума кривые жидкости и пара соприкасаются, то есть состав жидкости и пара в точках экстремума одинаков. Этот вывод называется вторым законом Коновалова. В термодинамической теории растворов оба закона Коновалова теоретически обоснованы. Их обоснование приводится в параграфе 5.5. Смеси, соответствующие по составу точкам экстремума, называются азеотропными, или нераздельно кипящими. Они ведут себя при нагревании как один компонент, их нельзя разделить простой перегонкой.
Равновесие «жидкость – пар» часто удобнее рассматривать при условии постоянства давления. В этом случае диаграммы «температура – состав» характеризуют температуру кипения жидкостей в зависимости от состава (кривая жидкости) и равновесный состав насыщенного пара при температуре кипения жидкости (кривая пара). Диаграммы «температура – состав» приведены в нижнем ряду на рис. 5.6. При этом следует обратить внимание, что кривые жидкости и область жидкой фазы находятся в этом случае в нижней части диаграммы, а область пара и кривая пара – в верхней части.
Компонент, который более летуч, в данном случае компонент 2, имеет более высокое давление насыщенного пара Рº2 , чем первый, и более низкую температуру кипения.
5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
В предыдущих параграфах главы мы рассматривали жидкости, имеющие достаточно высокое давление собственного пара. Их называют летучими жидкостями. К смесям летучих жидкостей относятся, например, нефть и продукты её первичной переработки: бензин, керосин.
Рассмотрим двухкомпонентную жидкую
летучую смесь с давлением паров над
чистыми веществами
![]() и
и
![]() .
Допустим, что оба компонента неограниченно
растворимы друг в друге и смесь паров
над идеальным раствором подчиняется
законам идеальных газов. Допустим также,
что
>
.
Такая система, как мы уже знаем, подчиняется
уравнению Дюгема – Маргулеса (5.13):
.
Допустим, что оба компонента неограниченно
растворимы друг в друге и смесь паров
над идеальным раствором подчиняется
законам идеальных газов. Допустим также,
что
>
.
Такая система, как мы уже знаем, подчиняется
уравнению Дюгема – Маргулеса (5.13):
dlnP1
= -
![]() dlnP2
dlnP2
По закону Дальтона,
![]() (5.29)
(5.29)
Молярные доли со штрихом относятся к фазе пара.
Из (5.13):
![]() , (5.30)
, (5.30)
откуда
![]() (5.31)
(5.31)
Заменим
![]() по уравнению (5.29)
по уравнению (5.29)
![]() (5.32)
(5.32)
Разделим левую и правую части (5.32) на dN2 :
![]() (5.33)
(5.33)
Общее давление пара над смесью двух летучих жидкостей равно сумме парциальных давлений:
Р = Р1 + Р2 (5.34)
Возьмём производную по N2 от обеих частей уравнения (5.34):
![]() (5.35)
(5.35)
Подставим в (5.35) значение dP1/dN2 из (5/33):
![]()
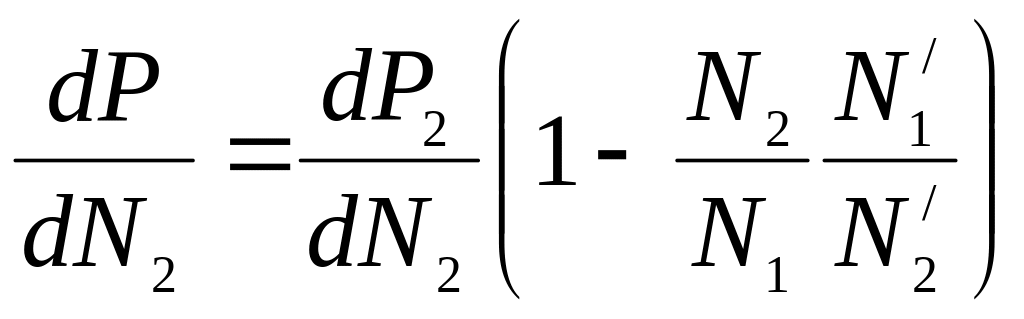 (5.36)
(5.36)
где
![]() называется коэффициентом разделения.
Он зависит от состава смеси. Чем больше
отличается состав смеси от состава
равновесного с ней пара, тем больше α
отличается от единицы и тем легче
разделить летучую смесь на компоненты
методом перегонки.
называется коэффициентом разделения.
Он зависит от состава смеси. Чем больше
отличается состав смеси от состава
равновесного с ней пара, тем больше α
отличается от единицы и тем легче
разделить летучую смесь на компоненты
методом перегонки.
Уравнение (5.36) является основным уравнением для неограниченно смешивающихся жидких бинарных летучих смесей. Проанализируем это уравнение. С ростом содержания компонента в растворе его парциальное давление всегда увеличивается, т.е. dP2/dN2 >0 и dP1/dN1 >0 , а общее давление пара над раствором с изменением состава раствора может как увеличиваться, так и уменьшаться.
Если общее давление пара над раствором увеличивается с ростом содержания второго компонента в растворе, т. е. dP/dN2 >0 то из уравнения (5.36):
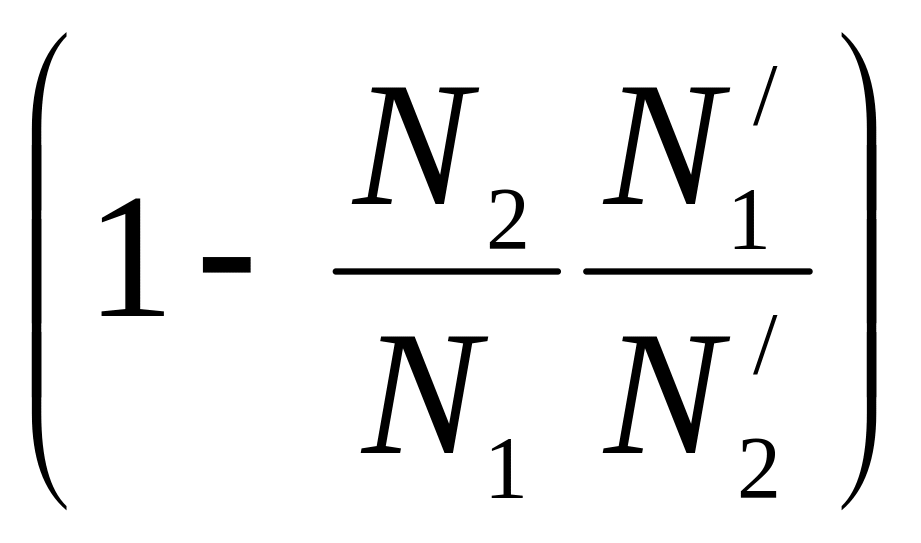 >
0 и
>
0 и
![]() (5.37)
(5.37)
и поэтому
![]() , а
, а
![]() (5.38)
(5.38)
И наоборот, если общее давление пара над раствором уменьшается с ростом молярной доли второго компонента N2, то
![]() , а
, а
![]() (5.39)
(5.39)
Неравенства (5.38) и (5.39) выражают первый закон Коновалова, сформулированный нами ранее на основе анализа диаграмм, в параграфе 5.3.: «Пар над смесью двух летучих жидкостей относительно богаче тем компонентом, добавление которого к жидкости повышает общее давление над раствором при постоянной температуре или понижает температуру кипения раствора при постоянном давлении».
Если на кривой Р=f(N2) имеется экстремум, то в точке экстремума
dP/dN2=0 (5.40)
Тогда, из (5.36) получим:
=0
и
![]() (5.41)
(5.41)
Отсюда получим, что в точке экстремума
![]()
![]() (5.42)
(5.42)
Соотношения (5.42) являются теоретическим обоснованием второго закона Коновалова, сформулированного на основе анализа диаграмм в параграфе 5.4.: «Точки экстремума на кривых общее давление пара – состав раствора или на кривых температура кипения – состав раствора отвечают растворам, состав которых одинаков с составом равновесного с ним пара».
