
- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
Если компоненты А и В образуют между собой химическое соединение АхВу, которое при плавлении не разлагается (т.е. плавится конгруэнтно), то фазовая диаграмма представляет собой фактически две диаграммы с эвтектикой (рис. 4.8). В качестве одного из компонентов в каждой из них выступает химическое соединение. Точка его плавления (точка D) называется дистектической точкой. Левая часть диаграммы представляет собой эвтектическую систему ААхВу; правая часть систему компонентов АхВу и В. Две эвтектические точки Е1 и Е2 характеризуют механические смеси кристаллов двух соответствующих компонентов в равновесии с их расплавами.
Линия ликвидуса Е1D характеризует температуру кристаллизации химического соединения из расплава А + АхВу (расплав 1), а линия ликвидуса Е2D кристаллизацию этого же компонента АхВу, но из расплава 2, т.е. В + АхВу. Граница полей двух расплавов показана пунктиром.
Если при плавлении химическое соединение АхВу частично диссоциирует на компоненты А и В, то линия ликвидуса вблизи точки дистектики имеет более округлую форму. При наличии нескольких химических соединений, образуемых компонентами А и В, каждому из них соответствует своя дистектическая точка, а диаграмма разбивается на соответствующее количество эвтектических систем.
В качестве примера на рис. 4.9. приведена фазовая диаграмма двойной системы волластонит (СаSiO3) алюминат кальция (CaAl2O4) с химическим соединением Ca2Al2SiO7 (геленит). Геленит плавится при 1595С без разложения. Волластонит имеет две полиморфные модификации, претерпевая структурную перестройку при 1125С.
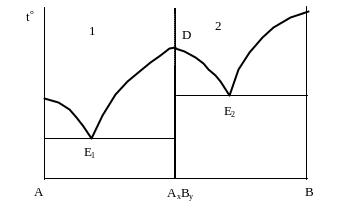
Рис. 4.8. Фазовая диаграмма двухкомпонентной гетерогенной системы с конгруэнтно плавящимся химическим соединением

Рис. 4.9. Двойная система волластонит - алюминат кальция
Поэтому в нижней левой части диаграммы имеется два поля твердых фаз: низкотемпературная -модификация волластонита сосуществует с геленитом до температуры полиморфного перехода t=1125C и высокотемпературная -модификация с геленитом выше этой температуры.
В природе существует много систем, в которых химическое соединение разлагается при плавлении (т.е. плавится инконгруэнтно). В этом случае состав образующегося расплава отличен от состава твердой фазы, из которой он образуется. Диаграмма такого типа приведена на рис. 4.10. Плавление химического соединения можно представить уравнением АхВу L + B, где L расплав. Состав расплава L при плавлении АхВу будет соответствовать точке Р на диаграмме. Эта точка называется перитектической, или реакционной точкой, а линия РС перитектической, или реакционной горизонталью.
Выше линии РС химическое соединение не существует, линия РМС приведена только для оценки положения точки М относительно вертикали, характеризующей состав химического соединения. На правой части рисунка приведена кривая охлаждения, соответствующая фигуративной точке N на диаграмме. Состав расплава в точке N находится между Р и АхВу, что видно из диаграммы. Вертикальная пунктирная линия, проведенная из точки N до оси состава, называется линией постоянного состава, или изоплетой. Она помогает определить порядок выделения фаз при охлаждении или нагревании системы.
 Рис.
4.10. Фазовая диаграмма бинарной системы
с инконгруэнтно плавящимся химическим
соединением и кривая охлаждения.
Рис.
4.10. Фазовая диаграмма бинарной системы
с инконгруэнтно плавящимся химическим
соединением и кривая охлаждения.
На участке N-1 расплав компонентов А и В охлаждается. В точке 1 расплав становится насыщенным относительно компонента В и на участке 1-2 происходит его кристаллизация. В точке 2 на кривой достигается температура перитектики и происходит перитектическая реакция
B + L(p) AxBy (4.15)
Этому процессу на кривой охлаждения соответствует участок 2-3. Кристаллы компонента В и часть жидкого расплава образуют при этих условиях химическое соединение. Этот процесс инвариантен, т.е. число степеней свободы на участке 2-3 равно нулю, т.к. в реакции (4.15) участвуют 3 фазы. После завершения перитектической реакции (точка 3) в системе остается две фазы неизрасходованная часть расплава и кристаллы АхВу. Система становится моновариантной и начинается дальнейшее падение температуры (участок 3-4 на кривой охлаждения). При этом из расплава кристаллизуется химическое соединение АхВу, а состав расплава меняется по линии ликвидуса от точки Р до точки эвтектики Е. В этой точке в эвтектической пропорции кристаллизуются химическое соединение АхВу и компонент А до полного затвердевания расплава.
На рис. 4.11 в качестве примера фазовой диаграммы с инконгруэнтно плавящимся химическим соединением приведена бинарная система лейцит (KAlSi2O6) кремнезем (SiO2). При охлаждении жидкого расплава, обогащенного лейцитом (левая часть диаграммы), сначала наблюдается кристаллизация лейцита (участок МС). Падение температуры и обогащение расплава компонентом SiO2 приводит к точке С, соответствующей перитектической реакции образования калиевого полевого шпата (ортоклаза) KAlSi3O8 по уравнению:
жидкость+ лейцит калиевый полевой шпат
Реакция идет до полного расходования лейцита, при постоянной температуре. После завершения перитектической реакции (точка С) оставшаяся жидкость охлаждается, из нее дополнительно кристаллизуется полевой шпат (участок СЕ), а при достижении эвтектического состава жидкости (точка Е) при температуре эвтектики кристаллизуются две твердые фазы: тридимит и полевой шпат, - до полного затвердевания расплава.
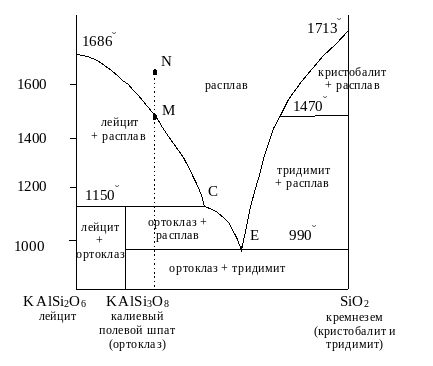
Рис. 4.11. Бинарная система лейцит-кремнезем
Кремнезем в пределах температур, показанных на диаграмме, существует в двух различных структурных формах, или полиморфных модификациях. Диаграмма показывает, что при температуре 1470С происходит полиморфное превращение кристобалита в тридимит. Однако в действительности этот процесс протекает очень медленно, и кристобалит часто присутствует как метастабильная фаза в условиях комнатных температур. При температуре ниже 1470С кремнезем должен кристаллизоваться в виде тридимита. Хотя на диаграмме и не показано, обе эти полиморфные модификации, прежде чем достичь комнатной температуры, должны перейти в кварц.
