
- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
Рассмотрим систему, состоящую из двух компонентов А и В, которые могут находиться при условии Р = const в виде жидкого расплава компонентов и (или) твердых кристаллов индивидуальных компонентов, не образуя твердых растворов, химических соединений и полиморфных модификаций. Правило фаз Гиббса в этом случае: С = КФ+1. Так как С 0, то Ф 3, а т.к. Ф 1, то С 2. Это значит, что число фаз, которые могут находиться в равновесии, не превышает трех, а вариантность системы не более двух и при К = 2 зависит от числа равновесно сосуществующих фаз по уравнению С = 3 Ф.
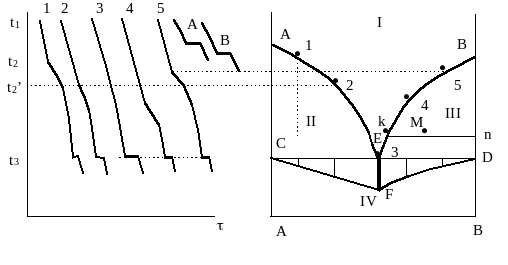
Нагреем смесь компонентов А и В, имеющих определенный состав (например, 90% А и 10% В), до состояния расплава и будем следить за изменением температуры в процессе естественного охлаждения расплава. Получим кривую охлаждения, рис. 4.5, кр. 1. На участке кривой t1t2 происходит охлаждение расплава. При t2 расплав становится насыщенным одним из компонентов (в данном случае А) и начинается его кристаллизация, сопровождающаяся выделением тепла. Поэтому термограмма в точке 2 меняет угол наклона (участок t2t3). Расплав при этом обогащается компонентом В и при t3 становится насыщенным и компонентом В. При этой температуре происходит одновременная кристаллизация компонентов А и В. Состав расплава, при котором компоненты кристаллизуются совместно, называется эвтектическим (от греческого легкоплавящийся). При температуре эвтектики Ф = 3, С = 0. Кристаллизация эвтектики изотермический процесс, т.к. состав расплава в процессе кристаллизации эвтектики не меняется. Время кристаллизации эвтектики пропорционально ее содержанию в системе. Чем ближе состав первоначально взятой смеси к эвтектическому, тем это время больше. В точке 3’ заканчивается процесс кристаллизации. Далее идет охлаждение смеси кристаллов. Сплавы, содержащие больше компонента А, называются доэвтектическими.
Их микроструктура состоит из первичных кристаллов А, окруженных затвердевшими мелкими пластинками или зернами микрокристаллов А и В в виде механической смеси.
Возьмем еще одну смесь А и В, но с меньшим относительным содержанием компонента А, чем в первой смеси. Получим такую же кривую охлаждения, но температура начала кристаллизации компонента А (t2/) будет на второй кривой ниже, чем на первой, т.е. расплав станет насыщенным по отношению к А при более низкой температуре.
а) б)
Рис. 4.5. Кривые охлаждения (а) и фазовая диаграмма (б) двухкомпонентной гетерогенной системы с эвтектикой.
Кристаллизация эвтектики не зависит от первоначального состава смеси, поэтому t3/ = t3. Если компоненты А и В взять в эвтектическом соотношении, то кривая охлаждения имеет вид (кр. 3), подобный кривой охлаждения чистого индивидуального компонента.
Сплавы, содержащие больше компонента В, чем в эвтектике, называются заэвтектическими (кривые 4, 5). Здесь процесс кристаллизации начинается с компонента В и обогащения расплава компонентом А до достижения эвтектического состава. Микроструктура таких твердых фаз обратна кристаллы В, окруженные эвтектикой. Таким образом, можно установить, какая фаза кристаллизуется первично: кристаллы А или В.
По кривым охлаждения строят фазовую диаграмму (рис. 4.5, б), перенося на нее точки начала кристаллизации компонентов в зависимости от первоначально взятого состава смеси.
Эта зависимость изобразится на диаграмме линиями АЕ и ВЕ, которые вместе образуют линию ликвидуса. Выше этой линии на диаграмме поле однородного жидкого расплава компонентов А и В; система в этой области однофазна (гомогенна) и би-вариантна. Точка Е характеризует состав эвтектики и температуру ее кристаллизации и называется эвтектической точкой. Линия ликвидуса характеризует расплавы, насыщенные соответствующим компонентом и, в то же время, температуру кристаллизации компонента в зависимости от состава расплава. Горизонталь CD, проходящая через точку эвтектики Е, называется линией солидуса (от греч. solidus твердый), или эвтектической линией. Ниже линии эвтектики в системе существуют только твердые фазы механическая смесь кристаллов А и В. Таким образом, линии ликвидуса и солидуса делят диаграмму на четыре фазовых поля:
I поле гомогенной жидкой фазы (расплав);
II поле двухфазного равновесия кристаллов А и расплава компонентов А и В;
III поле двухфазного равновесия кристаллов В и расплава компонентов А и В;
IV поле двух твердых фаз (кристаллов А и кристаллов В).
В соответствии с правилом фаз Гиббса, вариантность системы в любой точке на линии ликвидуса: С = 1, (К = 2; Ф = 2). Это означает, что только один параметр либо температуру, либо состав можно изменить произвольно (в некоторых пределах) так, чтобы число и характер фаз при этом не изменились. В точке эвтектики (Е) система безвариантна, С = 0, (К = 2; Ф = 3).
Это означает, что малейшее изменение любого параметра (состава системы или температуры) приведет к нарушению равновесия, и в системе произойдет изменение числа фаз или их природы.
В точке А (или В) система однокомпонентна, двухфазна (кристаллы компонента и его расплав) и инвариантна. Инвариантность системы в точках А, В и Е объясняет постоянство температуры в процессе кристаллизации (или плавления) чистого вещества и эвтектики.
Точное положение точки эвтектики на диаграмме довольно сложно установить при изображении линии ликвидуса по экспериментальным данным.
Решить эту проблему можно, используя графическое построение так называемый треугольник Таммана. Для этого на линии солидуса из точек, соответствующих составам смесей, взятых для снятия кривых охлаждения, наносят отрезки, соответствующие продолжительности температурных остановок в процессе кристаллизации эвтектики (см. рис. 4.5, а, кривые охлаждения). Отрезки откладывают перпендикулярно линии солидуса. Концы отрезков соединяют (треугольник CDF на рис. 4.5, б).
Для нахождения состава равновесных фаз, например, в точке М, проводят ноду kn через точку М до пересечения с линиями, ограничивающими данную гетерогенную область, параллельно оси абсцисс. Составы равновесных фаз определяют точки k и n: точка n состав твердой фазы (кристаллы В), а точка k состав расплава при данной температуре. Любая другая точка, лежащая на этой же ноде, будет соответствовать такому же составу фаз, как и точка М, изменятся лишь их количества. Определить количество равновесных фаз можно по правилу рычага. Например, для точки М отношение количества расплава к количеству кристаллов В равно отношению отрезков Mn / kM.
Более сложный вид имеет диаграмма с эвтектикой при наличии полиморфизма у одного из компонентов. Допустим, например, что компонент А имеет две полиморфные модификации и . Если температура полиморфного превращения t выше температуры плавления эвтектики, диаграмма имеет вид, изображенный на рис. 4.6. Кривая охлаждения для точки М (рис. 4.6, б) имеет два изотермических участка: переход в -модификацию и кристаллизация эвтектики. Поле I соответствует фазе и расплаву, а поле II фазе и расплаву. Ниже линии солидуса механическая смесь кристаллов В и -А.

 Рис. 4.6., 4.7. Фазовые диаграммы с эвтектикой
при наличии полиморфизма компонента:
t
> tэ, Рис.4.6. и t
< tэ , Рис. 4.7
Рис. 4.6., 4.7. Фазовые диаграммы с эвтектикой
при наличии полиморфизма компонента:
t
> tэ, Рис.4.6. и t
< tэ , Рис. 4.7
Если температура полиморфного перехода ниже температуры кристаллизации эвтектики, то диаграмма отличается от изображенной на рис. 4.5 наличием в области твердых фаз дополнительной линии t, параллельной линии эвтектики, которая разделяет области существования кристаллов А в (обл. I) и (обл. II)-модификации, рис. 4.7. Горизонтальные линии, соединяющие отдельные участки на диаграммах а) и кривых охлаждения б), имеют вспомогательный характер, указывая на соответствие температур.
Многие металлы образуют между собой сплавы эвтектического типа. Это, например, алюминий и олово, медь и кадмий, серебро и таллий, серебро и висмут, кадмий и свинец.
