- •Оглавление
- •2.10.1. Вопросы для самостоятельной подготовки 58
- •3.5.1. Вопросы для самостоятельной подготовки 73
- •4.1. Основные понятия и определения 76
- •Предисловие
- •Введение. Предмет, значение, Основные разделы и методы физической химии
- •Глава 1. Первый закон термодинамики. Термохимия
- •1.1. Основные понятия и определения
- •1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
- •1.3. Применение первого закона термодинамики к различным процессам. Закон Гесса
- •1.4. Термохимия
- •1.5. Термическая устойчивость соединений
- •1.6. Теплоемкость
- •1.7. Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
- •1.8. Контрольные вопросы, задания и тесты
- •1.8.1. Вопросы для самостоятельной подготовки
- •1.8.2. Задачи для самостоятельного решения
- •1.8.3. Тестовые задания для самоконтроля
- •Глава 2. Второй и третий законы термодинамики. Термодинамические потенциалы
- •2.1. Основные термодинамические понятия
- •2.2. Второй закон термодинамики
- •2.3. Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
- •2.4. Третий закон термодинамики. Постулат Планка
- •2.5. Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли
- •2.6. Термодинамические потенциалы
- •2.7. Свободная энергия Гиббса и закономерности появления самородных элементов
- •2.8. Характеристические функции. Уравнения Гиббса-Гельмгольца
- •2.9. Химический потенциал. Активность
- •2.10. Контрольные вопросы, задачи и тесты
- •2.10.1. Вопросы для самостоятельной подготовки
- •2.10.2. Задачи для самостоятельного решения
- •2.10.3. Тестовые задания для самоконтроля
- •Глава 3. Химическое равновесие
- •3.1. Уравнение изотермы химической реакции. Константа химического равновесия
- •3.2. Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
- •3.3. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции
- •3.4. Химическое равновесие гетерогенных химических реакций
- •3.5. Контрольные вопросы и задачи
- •3.5.1. Вопросы для самостоятельной подготовки
- •3.5.2. Задачи для самостоятельного решения
- •Глава 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
- •4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
- •4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
- •4.8. Твердые растворы. Понятие об изоморфизме
- •4.8.1. Непрерывные твердые растворы
- •4.8.2. Ограниченные твердые растворы
- •4.9. Контрольные вопросы
- •Глава 5. Растворы
- •5.1. Общая характеристика растворов
- •5.2. Парциальные молярные величины
- •5.3. Давление насыщенного пара компонента над раствором. Законы Рауля и Генри. Растворимость газов в жидкостях
- •5.4. Диаграммы «давление - состав», «температура – состав» и законы Коновалова для реальных систем
- •5.5. Закономерности общего давления пара над смесью двух летучих жидкостей. Обоснование законов Коновалова
- •5.6. Разделение жидких бинарных летучих смесей перегонкой
- •5.7. Осмотическое давление
- •5.8. Взаимная растворимость жидкостей
- •5.9. Закон распределения Нернста. Экстракция
- •5.10. Растворимость твердых веществ в жидкостях
- •5.11. Понижение температуры замерзания и повышение температуры кипения растворов
- •5.12. Контрольные вопросы
- •Литература
1.8.3. Тестовые задания для самоконтроля
1. Физическая химия изучает…
Выберите один ответ:
а) взаимные превращения различных видов энергии в зависимости от условий протекания процесса, а также возможность, направление и пределы самопроизвольного протекания процесса в рассматриваемых условиях ;
б) взаимосвязь физических и химических явлений, исследует законы протекания химических процессов во времени и состояния химического равновесия, а также строение и свойства молекул, фазовые превращения и состояния равновесия в гетерогенных системах;
в) применение закона Гесса и его следствий для вычисления тепловых эффектов различных физико-химических процессов: химических реакций, процессов растворения, кристаллизации и других;
г) закономерности осуществления химических реакций между молекулами органических веществ в соответствии с теорией их строения.
2. Функцией состояния системы называется…
Выберите один ответ:
а) параметр, изменение которого в ходе процесса не зависит от пути процесса, а определяется лишь начальным и конечным состоянием системы;
б) количество теплоты, которое выделяется или поглощается при необратимом протекании процесса, когда единственным видом работы является работа расширения идеального газа;
в) функция, при помощи которой (или ее производной) можно выразить в явном виде любой термодинамический параметр;
г) приращение изобарного потенциала при добавлении одного моля компонента к большому объему системы при постоянных P и Т .
3. Даны тепловые эффекты реакций ΔH°1 и ΔH°2
2H2 + O2 = 2H2Oж + ΔH°1 |
ΔH°1 = -571,68 кДж/моль |
4NH3 + 3O2 = 6H2Oж + 2N2 + ΔH°2 |
ΔH°2 =-1530,28 кДж/моль |
Тепловой эффект реакции образования аммиака из простых веществ ΔH°f298 при стандартном давлении и T=298К равен...
Выберите один ответ
а)- 46,19 кДж/моль ; б)54,86 кДж/моль; в)12,04 кДж/моль;
г) - 48,50 Дж/моль
4. Стандартный тепловой эффект реакции при постоянном давлении обозначается...
Выберите один ответ:
а) Qp ; б) ΔH ; в) ΔH°298 ; г) ΔU°298
5. Известны стандартные тепловые эффекты образования веществ ΔH°f298 кДж/моль:
Вещество |
CaMg(CO3)2 |
H2O |
Mg(OH)2 |
CaCO3 |
CO2 |
ΔH°f298 кДж/моль |
-2326,4 |
-285,8 |
- 915,1 |
- 1206,9 |
- 393,5 |
Стандартный тепловой эффект реакции CaMg(CO3)2 + H2O = Mg(OH)2 + CaCO3 + CO2
при постоянном давлении равен...
Выберите один ответ:
а) – 96,7 кДж/моль
б) 96,7 кДж/моль
в) – 1225,51 кДж/моль
г) 98,4 кДж/моль
6. Теплота сгорания углерода - это тепловой эффект реакции...
Выберите один ответ:
а) С(тв) + 1/2 O2(г) = CO(г)
б) СO(г) + 1/2 O2(г) = CO2(г)
в) С(тв) + O2(г) = CO2(г)
7. Изолированными называются системы, которые…
Выберите один ответ:
а) не обмениваются с окружающей средой ни веществом, ни энергией;
б) не обмениваются с окружающей средой веществом, но обмениваются энергией;
в) не обмениваются с окружающей средой энергией, но обмениваются веществом;
г) обмениваются с окружающей средой и веществом, и энергией.
8. Стандартный тепловой эффект химической реакции
CH3OH(г) + 3/2 O2 = CO2 + 2H2O(г)
равен -585·103 Дж/моль, а изменение теплоемкости в результате реакции ΔСp = 13,2 Дж/(моль·К). Теплоемкости веществ в данном интервале температур постоянны. Тепловой эффект химической реакции при 500 К и стандартном давлении равен...
Выберите один ответ:
а)– 673,29 кДж/моль; б) – 582,33 кДж/моль; в) 478 кДж/моль; г) – 275 кДж/моль
9. Термохимия – это раздел химической термодинамики, в котором изучают…
Выберите один ответ:
а) взаимные превращения различных видов энергии в зависимости от условий протекания процесса, а также возможность, направление и пределы самопроизвольного протекания процесса в рассматриваемых условиях;
б) взаимосвязь физических и химических явлений, исследует законы протекания химических процессов во времени и состояния химического равновесия, а также строение и свойства молекул, фазовые превращения и состояния равновесия в гетерогенных системах;
в) на основе закона Гесса и его следствий методы вычисления тепловых эффектов различных физико-химических процессов: химических реакций, процессов растворения, кристаллизации и других;
г) закономерности осуществления химических реакций между молекулами органических веществ в соответствии с теорией их строения.
10. Теплота возгонки вещества, ΔHвозг , может быть рассчитана по тепловым эффектам образования вещества в различных агрегатных состояниях по уравнению...
Выберите один ответ:
а) ΔHвозг= ΔHf(г) + ΔHf(ж) ; б) ΔHвозг = ΔHf(г) - ΔHf(т) ;
в) ΔHвозг = ΔHf(т) - ΔHf(г) ; г) ΔHвозг = ΔHf(ж) - ΔHf(г).
11. Если изменение теплоемкости системы в результате реакции, ΔСp > 0, то тепловой эффект реакции при увеличении температуры …
Выберите один ответ:
а) увеличится; б) уменьшится; в) не изменится.
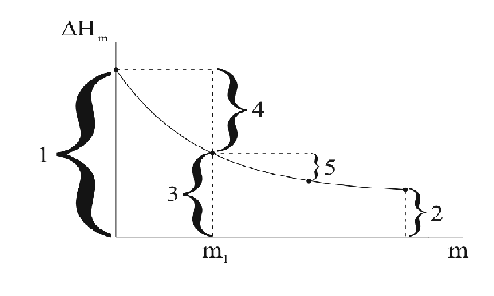
12. Последняя (полная) интегральная теплота растворения обозначена на графике цифрой...
Выберите один ответ: а) 1; б) 2; в) 3; г) 4; д) 5