
- •95 Положения Ленгмюра:
- •96 Особенности адсорбции газов:
- •97 Положения Ленгмюра тело-газ:
- •99 Молекулярная адсорбция из р-ров. Зависимость молекулярной адсорбции из равновесной концентрации адсорбата.
- •100 Молекулярная адсорбция из р-ров. Влияние молекулярную адсорбцию природы растворителя, природы адсорбата и тем-ры.
- •101 Ионная адсорбция из р-ров. Правило Панета-Фаянса
- •102 Ионообменная адсорбция. Уравнение Никольского
- •103.Основные характеристики и классификация дисперсных систем
- •106 Электрокинетические явления. Электрофарез.Электроосмос.Потенциал седиментации.
- •107 Молекулярно-кинетические св-ва дисперсных систем. Броуновское движение. Диффузия и седиментация
- •Седиментация
- •108 Осмотическое давление коллоидных р-ров
- •109Седиментационная устойчивость дисперсных систем. Гипсометрический з-н Лапласа
- •110 Агрегативная устойчивость коллойдных р-ров. Коагуляция. Правило коагуляции.
- •111 Кинематика коагуляции золей электролитами.
- •112 Факторы устойчивости лиофобных золей
- •113 Виды коагуляции электролитами
- •114 Коагуляция смесью электолитов. Аддитивное действие, синергизм, антаганизм
- •115 Защита колойдных частиц
- •116 Сенсибилизация и гетерокоагуляция
- •117 Общая характеристика р-ров вмс
- •118Наменклатура и классификация вмс
- •119 Основные особенности строения полимеров
- •132. Методы разрушения разбавленных суспензий.
- •133. Пасты.
- •135. Эмульсии. Классификация.
- •136. Стабилизация эмульсий.
- •137. Методы получения эмульсии.
- •138. Методы определения типа эмульсии.
- •139. Пены
- •140. Стабилизация пен.
- •141. Разрушение пен.
89 Поверхностная энергия и натяжение….
Рассмотрим гетероген. систему, состоящую из жидкости и газа. Молекула А, наход. внутри фазы, взаимодействии со
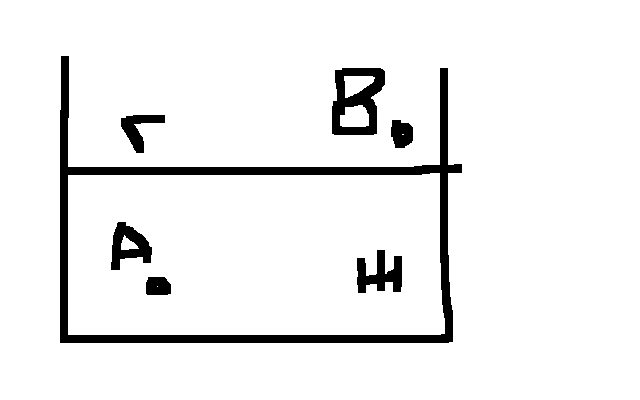 всех
сторон с такими же молекулами. Молекула
В на границе раздела фаз взаимод. с
молекулами жид-ти и газа. В жид. фазе
силы межмолекул. взаимод-я F11
больше, чем в газообразной F22.
Возник результир. сила Р напр-я внутрь
жид . фазы. Р= F11-
F22
всех
сторон с такими же молекулами. Молекула
В на границе раздела фаз взаимод. с
молекулами жид-ти и газа. В жид. фазе
силы межмолекул. взаимод-я F11
больше, чем в газообразной F22.
Возник результир. сила Р напр-я внутрь
жид . фазы. Р= F11-
F22
Чем больше различ. силы межмолек-го. взаимод-я в граничащих фазах, тем больше будет внутр. давл-е.

Поверхн натяжение-величина, показ-я как измен-ся поверх-я эн-я Гиббса с ростом S поверхности.
Все в-ва повлиянию на поверхн. натяж-е дел:
ПАВ –снижают пов. Нат.
ПИВ(поверхн-е иноактивные в-ва) повыш. Поверхн. натяж-е.
ПНВ (поверхн. неактивные в-ва)
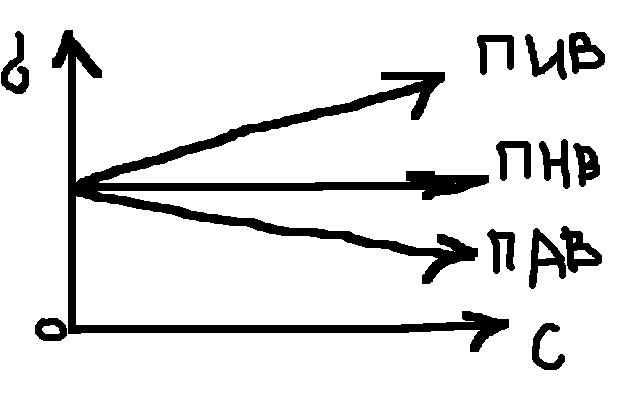
С
ростом температуры пов. нат. сниж-ся.
![]() -температ-й коэфф. пов. нат. Темпер-ра,
при кот. поверхностное натяжение обращ-ся
в 0, наз-ся критической.
-температ-й коэфф. пов. нат. Темпер-ра,
при кот. поверхностное натяжение обращ-ся
в 0, наз-ся критической.
90
Класификация поверхностных явлений![]() Первая
группа:
те явл-я в ходе кот пов-я энергия Гиббса
сниж-ся за счет уменьш-я площади пов-ти.
Первая
группа:
те явл-я в ходе кот пов-я энергия Гиббса
сниж-ся за счет уменьш-я площади пов-ти.
- принятие в-вом округлой формы(сферич-й). если некот. частица одного и того же объема и массы может нах-ся в сферич. и кубич-й форме, то переход из сферич-й в кубич-ю привод. к уменьш-ю площади пов-ти в 1,24 раза.
-укрупнение частиц путем их слипания или слияния.
Слипание частиц тверд. фазы-коагуляция, жидкой – коалисценция.
Вторая группа: те процессы, привод. к сниж-ю площади пов-ти.
Адсорбция – изм-е концентр-и растворенного в-ва в поверхн. слое.
Адгезия – слипание 2-х разнородных тверд. тел за счет межмолек-х сил.
Смачивание – разновидность адгезии, при взаимод. типа ж—тв.
Растекание - разновидность адгезии, при взаимод. типа Ж—Ж.
91 Смачивание – поверхн-е явление, заключенное во взаимод-и жид. с тверд. телом при наличии контакта с воздухом.
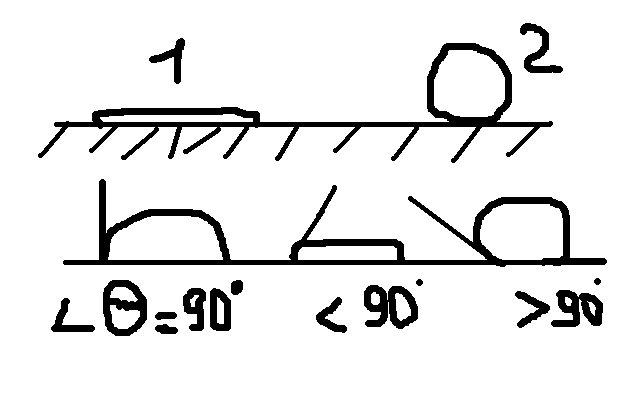
ж-ть полностью растек-ся по поверхности.
Капля не смачивает пов-ть(ртуть на неметал поверхностях)
Мерой
смачив-я пов-ти явл-ся краевой
угол смачивания (угол,
кот образует жид-ть с ТВ пов-ю) (![]() ).
Если
меньше 90, то пов-ть – смачиваемая, если
больше 90, несмачиваемая(тальк, сера).
).
Если
меньше 90, то пов-ть – смачиваемая, если
больше 90, несмачиваемая(тальк, сера).
Капля,
нанесенная на тв. пов-ть принимает ту
или иную форму в зав-ти от 3-х сил пов.
натяж-я (![]() тв-г,
тв-ж,
тв-г,
тв-ж,![]() ж-г).
Когда разность между
тв-г,
тв-ж
будет меньше, чем
ж-г,
то капля растек-ся полностью, если
наоборот капля растекаться не будет.
ж-г).
Когда разность между
тв-г,
тв-ж
будет меньше, чем
ж-г,
то капля растек-ся полностью, если
наоборот капля растекаться не будет.
92 Сорбция – поглощение в-вом других в-в. Если процесс сорбции идет только на поверхности – адсорбция. Если поглощ-е в-во диффундирует внутрь поглотителя и распред-ся по всему объему – абсорбция. В-во, кот. поглощ-ся – адсорбат, то в-во на пов-ти кот. идет процесс – адсорбент. Адсорбция = кол-ву адсорбата Х, приходящ-ся на единицу площади пов-ти адсорбента. Г=Х/S. Адсорбция: ж-г, г-тв, р-р –тв.
Физич-я Адсорбция обусловлена силами межмолек-го взаимод-я. Особенности:
-обратимость (десорбция)
-отсутствие стехиометрич-х соотношений
-малая специфичность
-незначит. теплота адсорбции
-с повыш. темпер-ры физ. адсорбция сниж-ся
2.Хим. адсорбция осущ-ся путем хим. р-ции. Особ-ти:
-необратимость
-выс. специф-ть
-выс. теплота адсорбции
-повыш-е темпер-ры способствует хим. адсорбции.
93 ПАВ- в-ва, сниж-е поверхн. натяж-е (спирты, жирн. к-ты, их соли и амины). ПАВ явл-ся амфифильными, т.е. они сост. из полярн. и неполярн. частей, полярн. часть гидрофильная, неполярн. – гидрофобная. В случае орган. молекулы неполяр. ч-ть – чистые УВ, полярная сод. электрофильные атомы (О, N, S, P…). Пример ПАВ – мол-ла мыла. Энергитич-ки более выгодно мол-ле ПАВ нах-ся на границе раздела фаз, неполярн. ч-ть будет ориентир-ся к неполяр. воздуху, а полярн. – к воде.
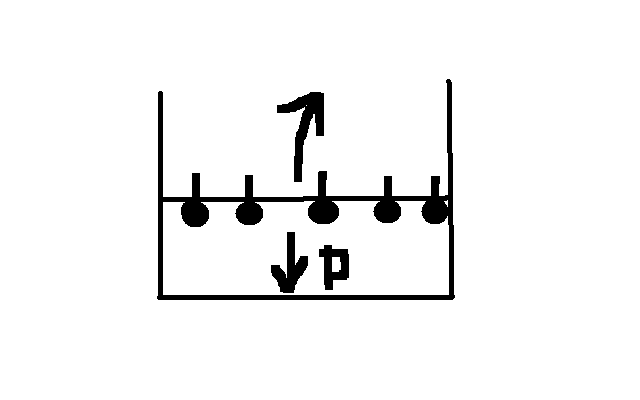 Таким
образом мол-лы взаимод-ют сразу с 2-мя
фазами, что снижает внутр. давление, что
приводит к уменьш-ю избыточной эн-и
повер-х частиц, что означ. сниж-е пов-го
натяж-я.
Таким
образом мол-лы взаимод-ют сразу с 2-мя
фазами, что снижает внутр. давление, что
приводит к уменьш-ю избыточной эн-и
повер-х частиц, что означ. сниж-е пов-го
натяж-я.
94
Поверхн-я
активн-ть
– величина, показ-я, насколько сильно
измен-ся поверх-е натяж-е с увелич-ем
концентр-и в-ва.  (Дж м/моль).
(Дж м/моль).
1.Пов акт-ть возрастает с уменьш-ем полярности в-ва.
2.В
гомологич. ряду жирн к-т прослеж-ся
четкие закономерности в изменении ![]() .
Она повыш. с увелич-ем длины УВ-го
радикала.
.
Она повыш. с увелич-ем длины УВ-го
радикала.
Правило
Дюкло-Траубе:
![]() предельных
жирн. к-т увелич-ся 3 – 3,5 раза при удлинении
УВ-й цепи на одно звено.
предельных
жирн. к-т увелич-ся 3 – 3,5 раза при удлинении
УВ-й цепи на одно звено. 
Ур-е
изотермы адс-и Гиббса:
 ,
где Г – адсорбция, С – конц-я адсорбата,
Т – темпер-ра при кот. протек. адс-я. Ур-е
связ. величину адс-и со спос-ю растворенного
в-ва изменять поверх-е натяж-е. Если в-во
пониж поверх-е натяж-е, то больш-во
адсорбата концентрир-ся на границе
раздела фаз, если наоборот - больш-во
адсорбата распред-ся внутри фазы.Чтобы
рассчитать адс-ю по ур-ю Гиббса надо
найти произв-ю поверхн. нат-я по конц-и.
Производная = тангенсу угла наклона
касательной, провед-й к определенной
точке.
,
где Г – адсорбция, С – конц-я адсорбата,
Т – темпер-ра при кот. протек. адс-я. Ур-е
связ. величину адс-и со спос-ю растворенного
в-ва изменять поверх-е натяж-е. Если в-во
пониж поверх-е натяж-е, то больш-во
адсорбата концентрир-ся на границе
раздела фаз, если наоборот - больш-во
адсорбата распред-ся внутри фазы.Чтобы
рассчитать адс-ю по ур-ю Гиббса надо
найти произв-ю поверхн. нат-я по конц-и.
Производная = тангенсу угла наклона
касательной, провед-й к определенной
точке.
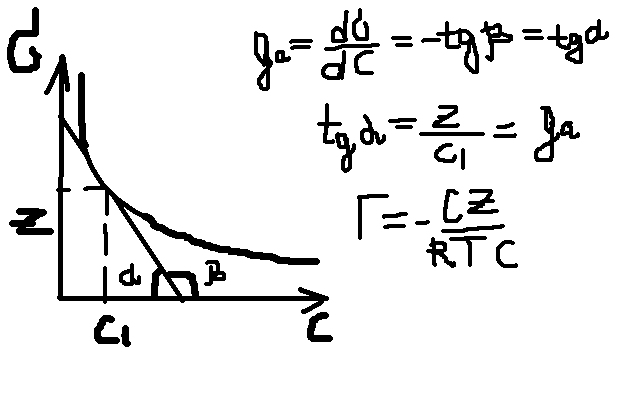

По
мере увели-я конц-и адс-я вначале резко
возрастает, затем все медленней приближ-ся
к некот. величине – предельной адс-и
(![]() ).
).

95 Положения Ленгмюра:
1.Адсорбция мономолекулярна,
2.при
адс-ции устанавливается динамич-е
равновесие,при кот. скорости адс-ции и
десорбции =. Это равновесие опис-ся
константой адс-ции.  Ур-е Ленгмюра :
Ур-е Ленгмюра : 
Чтобы
найти постоянную в ур-и Ленгмюра его
след привести к линейной ф-ме, для этого
левую и правую части перевернуть: 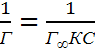 +
+ ![]() .
.
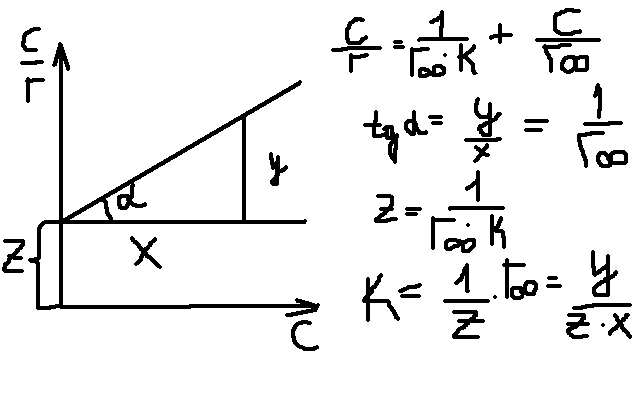
96 Особенности адсорбции газов:
Пов-ть тверд тела в отличе от пов-ти ж-ти имеет слож хар-р.
Адс-ция происх не на всей пов-ти, а лишь на активных центрах.
Адс-я кинетически обратима, наряду с адс-ей газа постоянно происх десорбция.
Пов-ть адсорбента часто бывает пористой.
Наряду с адс-ей может происходитьпоглощ-е газа или пара всем объемом тверд тела.
Адс-ю газа на тверд адсорбенте обозн. а и колич-но выражают: а=n/m, n – хим кол-во газа,m- масса адс-и. Величина адс-и зависит от: 1.темпер-ры, 2.конц-ции газа или пара в поверхн. слое, 3.природы тверд тела, 4.природы газа.
Адс-ю газа можно хар-ть зав-ю кол-ва адсорбир-го в-ва от равновесного давления при пост. темпер-ре. Изотермы адс-ции:

Кривая, располож-я выше отвеч. более низкой темпер-ре. Для аналит. описания адс-и Фрейндлих вывел эмпирич. ур-е, кот. связ. адс-ю с давлением:
![]() ,
где р- парциал давл-е, а- адс-я, в и 1/n
– постоянные . Для того чтобы определить
пост в ур-и Фр. перепис в логорифм ф-ме
и строят график зав-ти:
,
где р- парциал давл-е, а- адс-я, в и 1/n
– постоянные . Для того чтобы определить
пост в ур-и Фр. перепис в логорифм ф-ме
и строят график зав-ти:

97 Положения Ленгмюра тело-газ:
Адс-ция явл-ся локализованной и наз-ся силами, близкими к химическим.
Адс-я мол-лы адсорбата происх. на активных центрах адсорбента (возвышения и пики на пов-ти)
Акт-е центры хар-ся большой ненасыщенностью силового поля, поэтому на них удерж-ся налетающие мол-лы газа.
Акт-й центр может взаимод-ть только с одной мол-лой адсорбата, в результате чего на пов-ти образ-ся мономолек-й слой.

Адсорбц-е мол-лы удерж-ся данным активным центром в теч. определенного промежутка времени.
Время пребывания мол-лы газа на актив. центре не завис. от того заняты соседние центры или нет.
Ур-е
Ленгмюра можно использовать только при
усл-и, что адс-ция в-ва сопровожд-ся
образованием мономолек-го слоя(небольшое
давление и темпер-ра выше критич-й). , Р – парциал. давл-е газа, кот. адсорбир-ся
на адсорбенте.
, Р – парциал. давл-е газа, кот. адсорбир-ся
на адсорбенте.
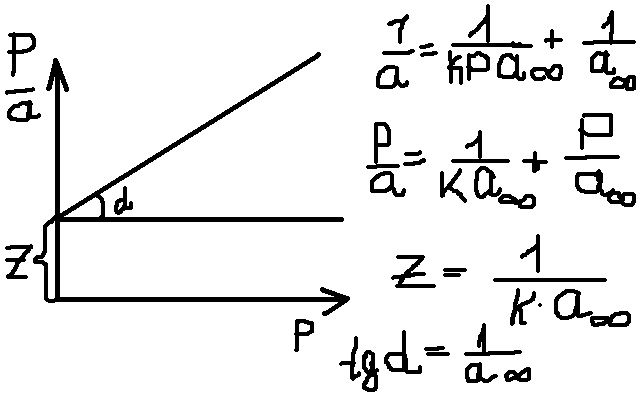
Ученый Поляни обнаружил, что встреч-ся и S-образные изотермы
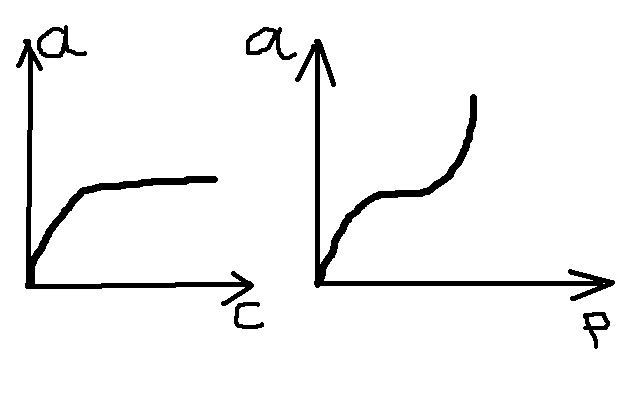
1.адс-я созд-ся чисто физич силами, 2.на пов-ти адсорбента нет актив-х центров, 3. силовое поле,обусл-е адс-ю действует на расстояния, кот. больше,чем размеры отд-х мол-л адсорбата, 4.адсорбц-е силы не завис. от темпер-ры, и с ее измен-ем адсорбц-й объем не изм-ся.
Зависимость адсорбции газов от свойств адсорбента. Все адсорбенты дел-ся на 2 группы:
1.гладкие, 2. Пористые. Адсорбция на непористых адсорбентах завис:
-сродства адсорбента к адсорбату, т.е. на полярн адсорбентах лучше адс-ся полярн асорбаты и наоборот.
-от степени дисперности адсорбента(измельч-ти)
Пористые адсорбенты завис от: 1.Размеров пор, 2.пористости.
В зав-ти от размеров пор, пористые адсорбенты дел:
Макропористые (размер пор больше 100-200 нм)
Переходнопористые (1,5-100 нм)
Микропор-е (меньше1,5- 0,5 нм)
Если поры мелкие, то идет простое заполнение молекулами адсорбата, если глубокие, то происх конденс-я газа в этих порах.
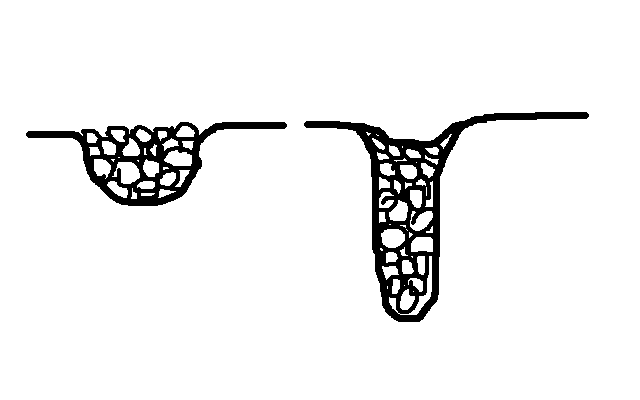
Кол-во
поглощ-го порами газа хар-ся степенью
заполнения пор  . Пористость – отнош-е объема пор к общ.
объему тела.
. Пористость – отнош-е объема пор к общ.
объему тела.
Адс-ция газов на практике примен-ся для:
-разделения газ. смесей
-поглощ-е отравл-х газов
-осушки газов
-в различ каталитич. процессах.
