
- •Основные понятия термодинамики. Термодинамические системы, состояния и характеристики. Термодинамические процессы
- •2 Первое начало термодинамики
- •3 Первое начало термодинамики для различных термодинамических процессах
- •4 Работа расширения газа при различных термодинамических процессах
- •7 Теплоемкости веществ зависимость теплоты реакции от температуры уравнение Кирхгофа
- •2 Реакция нейтрализации
- •9 Второе начало термодинамики Энтропия
- •10Связьэнтропии с теплотой обратимого процесса математическое выражение второго начала термодинамики цикл Карно
- •11 Изменение энтропии в обратимых и необратимых процессах
- •12 Статистическая энтальпия
- •13 Третье начало термодинамики Расчет изменения энтропии при нагревании системы изотермическое расширение и сжатии газа и фазовых переходах Абсолютная энтропия
- •14Понятие о термодинамических потенциалах Закрытые системы изотермо- изохорные процессы свободная энергия Гельмгольца
- •15 Закрытые системы изотермо-изобарные процессы свободная энергия Гиббса для обратимых и необратимых процессов
- •Свободная энергия и направление
- •Изменение свободной энергии при изменении температуры и давлении
- •Расчет изменения энергии Гиббса в химических реакциях Стандартная энергии Гиббса образования и сгорания веществ
- •Химический потенциал
- •Равновесное состояние Закон действующих масс
- •21Энергия Гиббса Химических реакций
- •22Стандартное изменение Гиббса химической реакции зависимость dGр-ц от концентрации участников реакции
- •23 Закон Гесса для канстанты равновесия
- •24 Зависимость константы равновесия реакции от t
- •25 Принцип ле Шателье Влияние изменения давления на химическое равновесие
- •26 Фазовое равновесие, основные понятия и условия фазового равновесия
- •27 Правило фаз Гибсса
- •28 Уравнение клаузиса-клайперона общая форма
- •29 Зависимость давления насыщенного пара от температуры
- •67.Гальванические элементы и их электродвижущая сила (эдс)
- •68.Концентрационные цепи
- •69. Потенциометрия. Определение рН р-ров.
- •70.Средняя и мгновенная скорость хим. Р-ций. Закон действующих масс (здм) для скоростей. Константа скорости р-ции и период полупревращения.
- •71. Молекулярность и порядок р-ции.
- •74. Кинетика параллельных р-ций.
- •75. Кинетика последовательных р-ций 1-го порядка.
- •76.Кинетика обратимых р-ций 1-го порядка.
- •77. Кинетика сопряженных и цепных р-ций.
- •78. Влияние т на скорость х. Р. Правило Вант-Гоффа
- •80. Ур. Аррениуса. Определение энергии активации.
- •81. Катализ. Особ. Катализа. Мех-м….. Катализаторами
Расчет изменения энергии Гиббса в химических реакциях Стандартная энергии Гиббса образования и сгорания веществ
1 рассчитывают изменения энергии Гиббса можно производить различными способами
1 способ G=H-TS DGр-ц=DHp-TDSр-ц
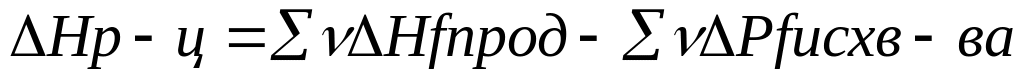
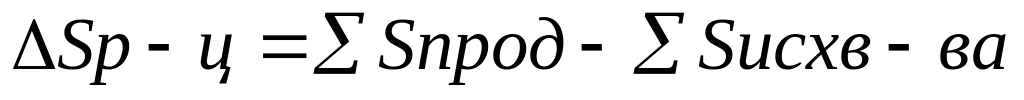 2
способ если извесны конкретные значения
изменения энергии Гиббса продуктов и
исходных веществ то можно
2
способ если извесны конкретные значения
изменения энергии Гиббса продуктов и
исходных веществ то можно
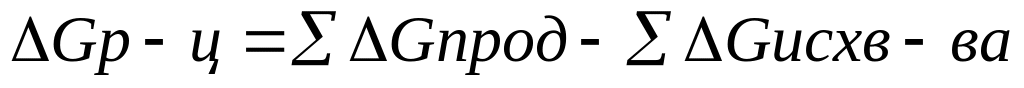
Энергию Гиббса реакции можно рассчитать используя энергию Гиббса образования и сгорания веществ DGсгор DGc
![]() DGобр
DGf
DGобр
DGf
![]() Энергия
Гиббса сгорания вещ-ва это изменение
Энер Гиббса реакции окисления 1 м данного
вещ-ва до конечных оксодов
Энергия
Гиббса сгорания вещ-ва это изменение
Энер Гиббса реакции окисления 1 м данного
вещ-ва до конечных оксодов
Стандартная энергия Гиббса образования вещ-ва это изменение Энергии Гиббса образования из простых веществ одного Моля вещ-ва при стандартных условиях
Принято считать что стандартная энергия Гиббса образования простых вещ-в=0 и стандартная энергия Гиббса сгорания оксидов в max степени окисления=0
Химический потенциал
Известно что в химических реакциях меняется количество веществ тех или иных участников то поэтому энергия Гиббса в состоянии равновесия зависит также от количества компонентов системы
G=f(PTn…..ni) по этому мы вводим дополнительные члены в уравнение dG=Vdp-SdT
dG=VdP=SdT+m1n1+…+mini m- является хим потенцалом каждая из множителе частная производная энергии Гиббса по количеству соответствующих веществ
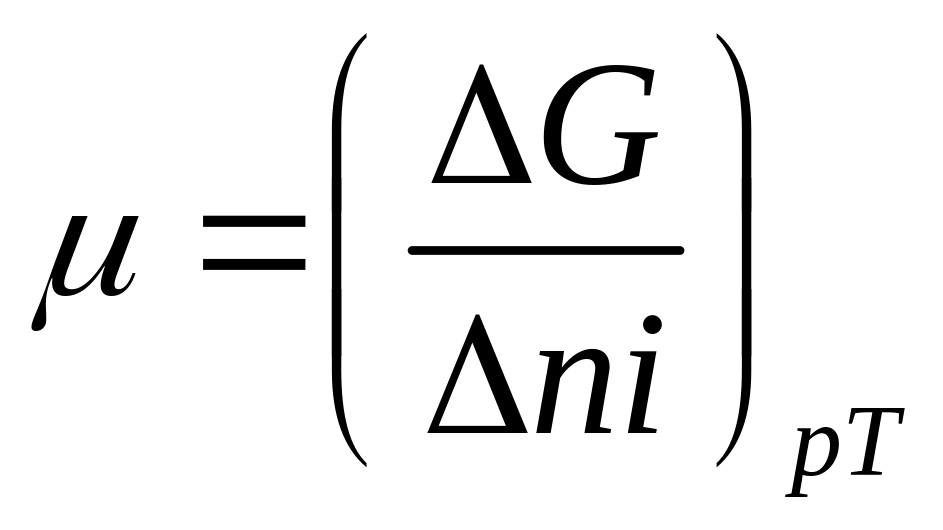 подобно
тому как теплота является движущей
силой при теплопередачи так как и
химический потенциал является движущей
силой при массовом переносе как и
остальные интенсивные переменные в
соответствующих процессах химический
потенциал вещества выравнивается и в
момент достижения равновесия становиться
одинаковым во всех существующих фазах
если условия реакции является изотермо-
изобарные то данное выражения сводится
к сумме порциальных энергий Гиббса
относится к отдельным компонентом
системы
подобно
тому как теплота является движущей
силой при теплопередачи так как и
химический потенциал является движущей
силой при массовом переносе как и
остальные интенсивные переменные в
соответствующих процессах химический
потенциал вещества выравнивается и в
момент достижения равновесия становиться
одинаковым во всех существующих фазах
если условия реакции является изотермо-
изобарные то данное выражения сводится
к сумме порциальных энергий Гиббса
относится к отдельным компонентом
системы
![]()
хический потенциал это часть энергии Гиббса системы которая приходит на 1моль вещества след. Для изотермо-изобарн процессов хим M компонента системы отождествляется с молярной массой энергией Гиббса
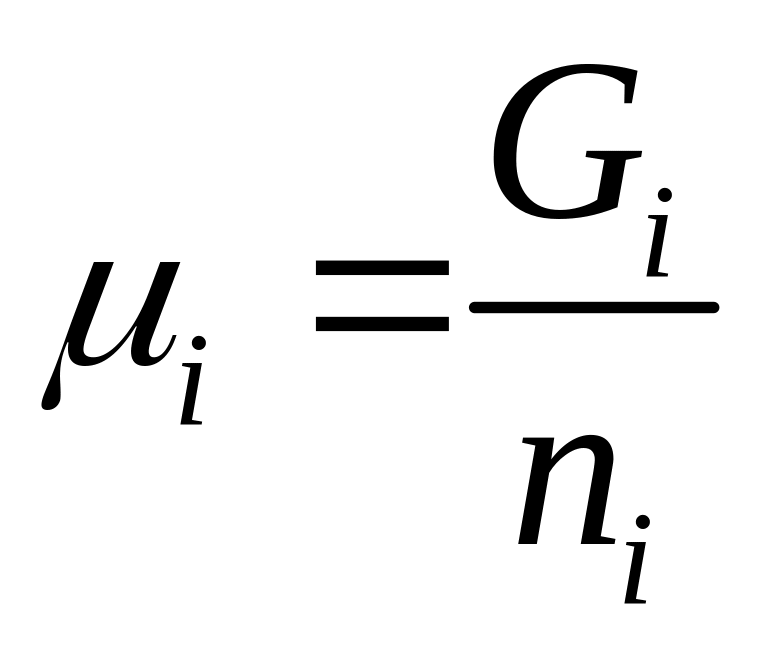 для изотермо-изохор
условий хим потенциал =DT=0
DV=0
для изотермо-изохор
условий хим потенциал =DT=0
DV=0
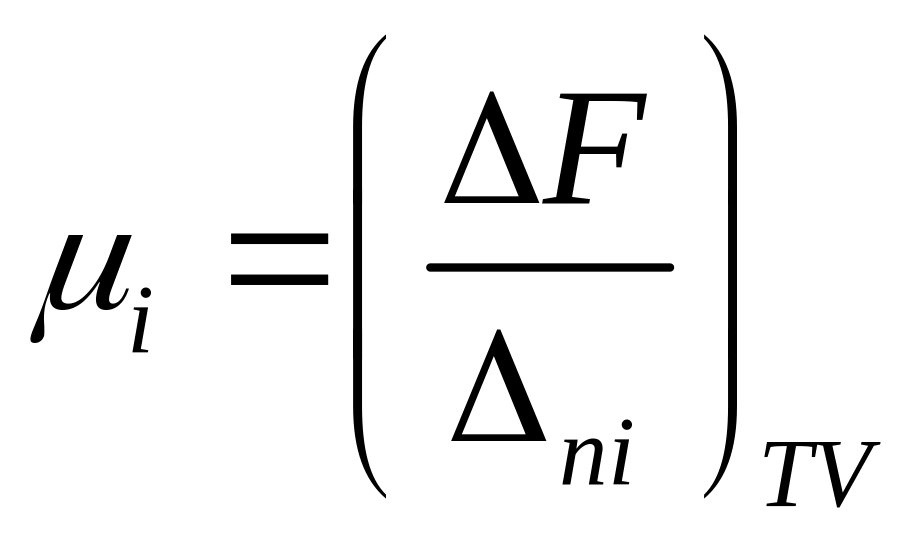
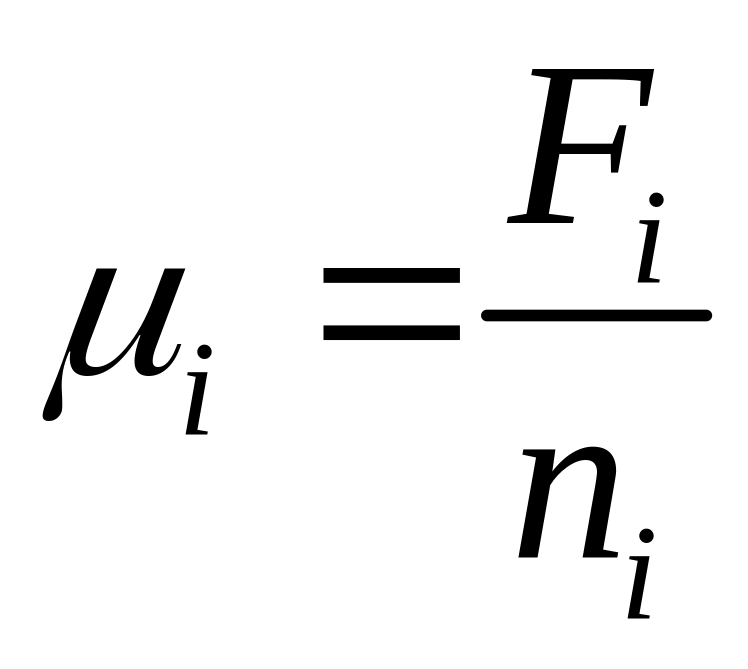
Химический потенциал есть функция опред направления и предел самопроизвольного перехода данного компонента из одной фазы в другую при соответствующих превращениях путем испарения взаимодействия и кристаллизации
Химический потенциал является функцией состояния системы зависит от P T V состояния системы для одного моля идеального газа справедливо равенство
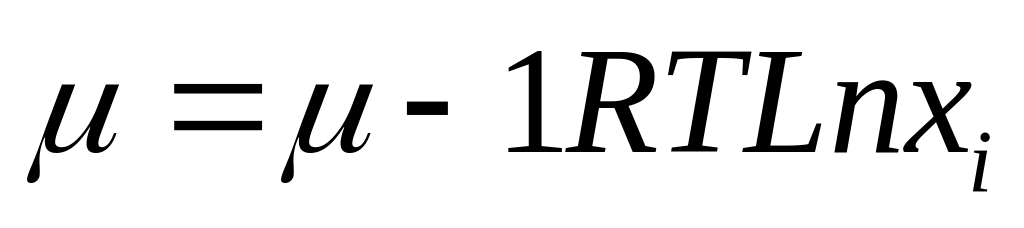
![]() -химический
потенциал
-химический
потенциал
В случае когда колич газа=1 условием самопроизв протекание процесса в системе может служить след неравенство
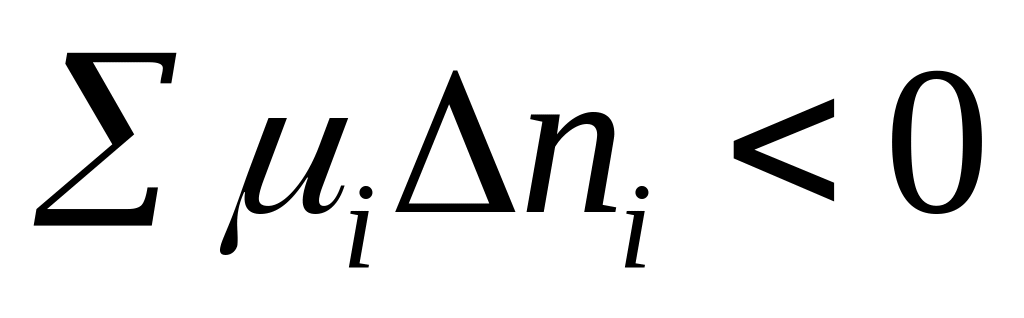 процесс идет
самопроизвольно
процесс идет
самопроизвольно
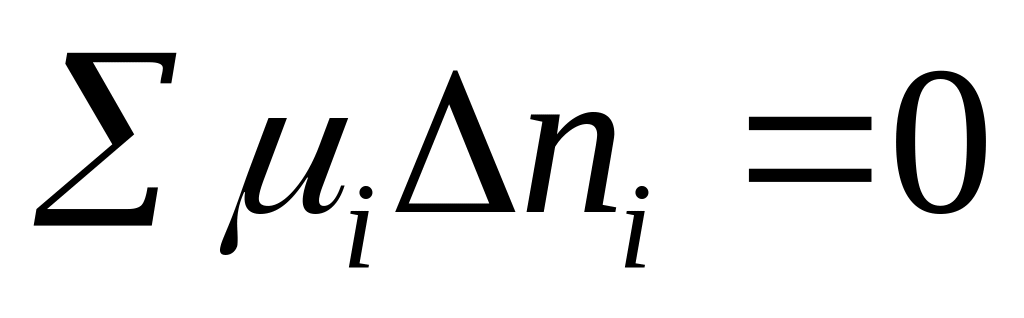 в системе наблюдается
динамическое равновесие
в системе наблюдается
динамическое равновесие
Равновесное состояние Закон действующих масс
о химическом равновесии можно говорить при выполнении 2-х условий 1 реакция должна быть обратима 2 должна находится в состоянии термодинамического равновесия
На всякое состояние покоя система рассматривается как термодинамическое равновесия при отсутствии вид а реакции не свидетельствует о наступлении сущ равновесия Поэтому хим равновесия следует понимать не как состояние покоя а как процесс идущий беспрерывно с одинаковой скоростью в обоих направлениях при этом концентрация вещества не изменяется что и создает видимость покоя такое состояние системы принято называть химическим динамическим равновесием
Пример CH3COOH+C2H5OH-----CH3C=O +H2O
-O-C2H5
В данном случае одновременно протекает как реакция этерификации так и реакция омыления сложного эфира В начальный момент времени скорость обоих реакций различны но потом наступит момент когда V1=V2 и система переходит в состояния равновесия хотя и в этот момент идут реакции образования эфира и его омыления Tобр в равновесной системе не ни продуктов ни реагентов все вещества одновременно участвуют в создании равновесного вещества наз продуктами и реагентами только формально
Закон Действующих масс для равновесной системы в состояния равновесия отношения производ действующих масс продуктов реакции к произведению действующих масс вещества возведенные в степени равные в стехиометрических коэффициентах есть величина постоянная наз константой равновесия
Под действующими массами понимают равновесные концентрации участников реакции
Пример в системе протекает реакция
aA+bB---cC+dD
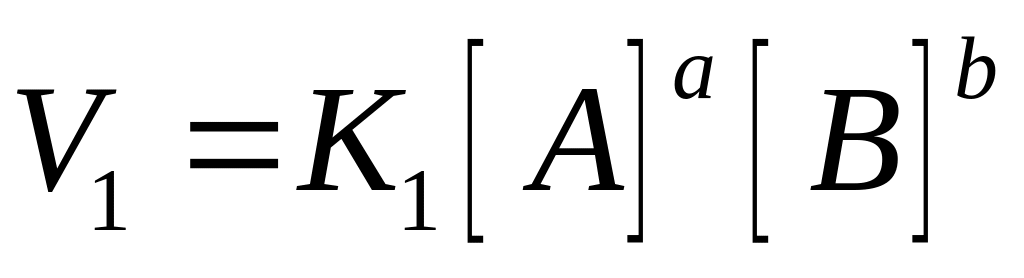 V1=V2
V1=V2
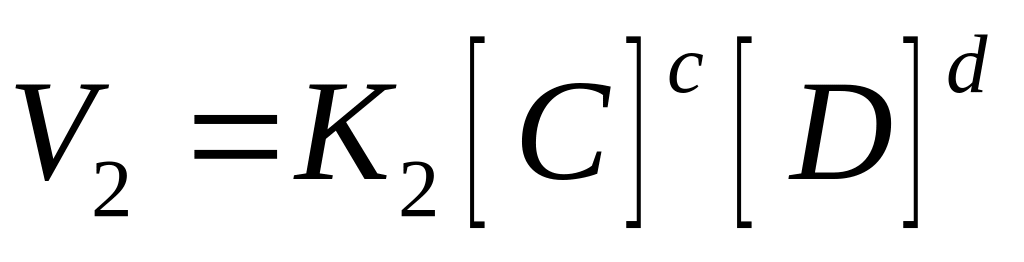
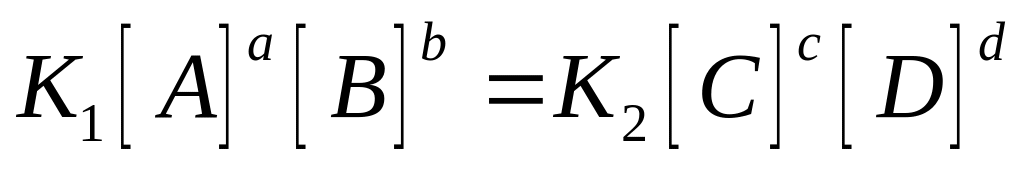
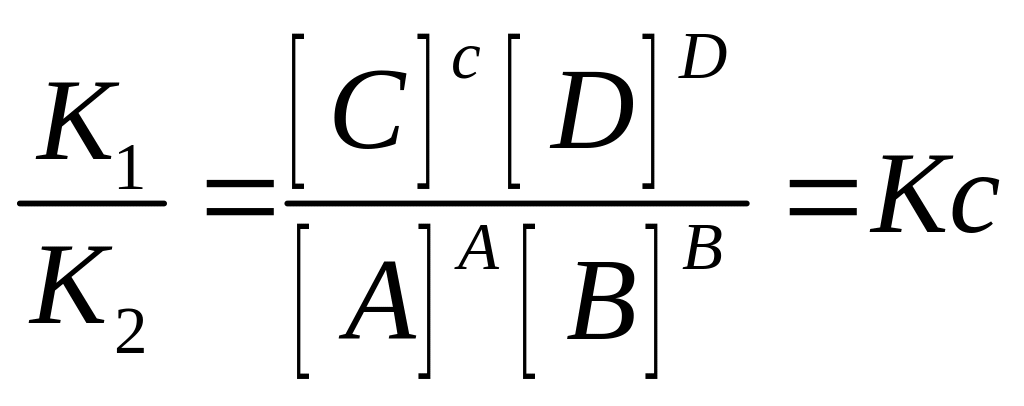 константа
равновесия через концентрацию участники
реакции газы то вместо равновесной
концентрации в данное выражение
подставляют давление газа
константа
равновесия через концентрацию участники
реакции газы то вместо равновесной
концентрации в данное выражение
подставляют давление газа
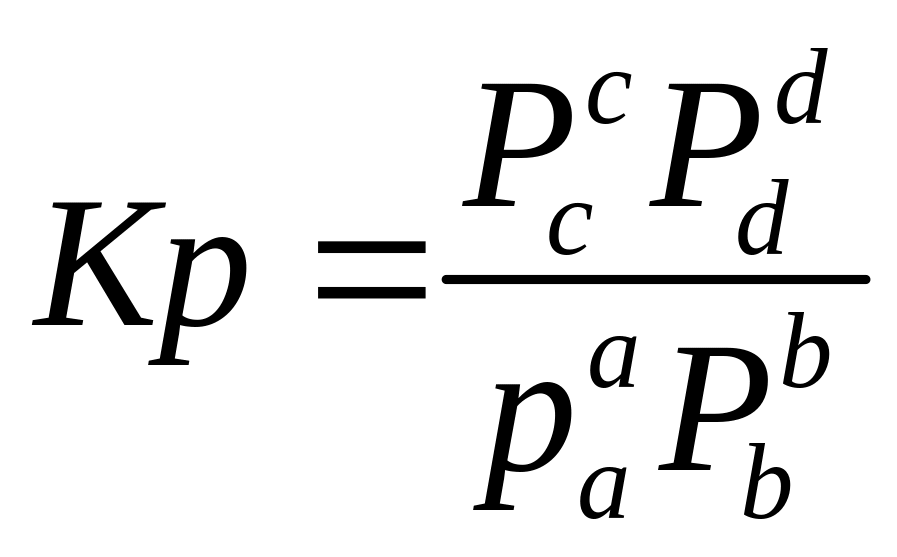
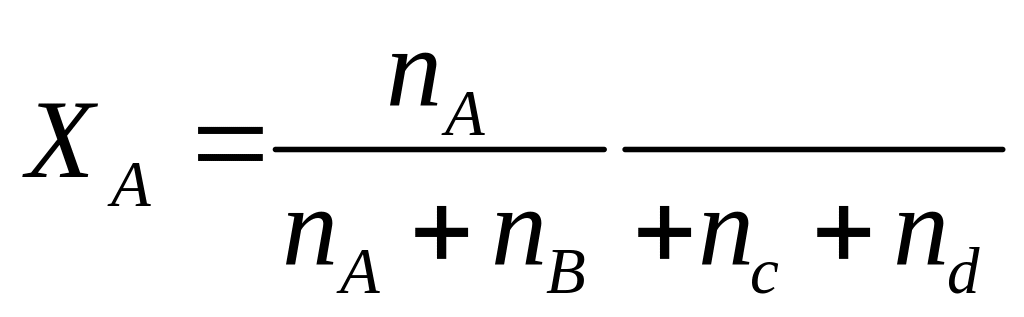 мольная доля
мольная доля
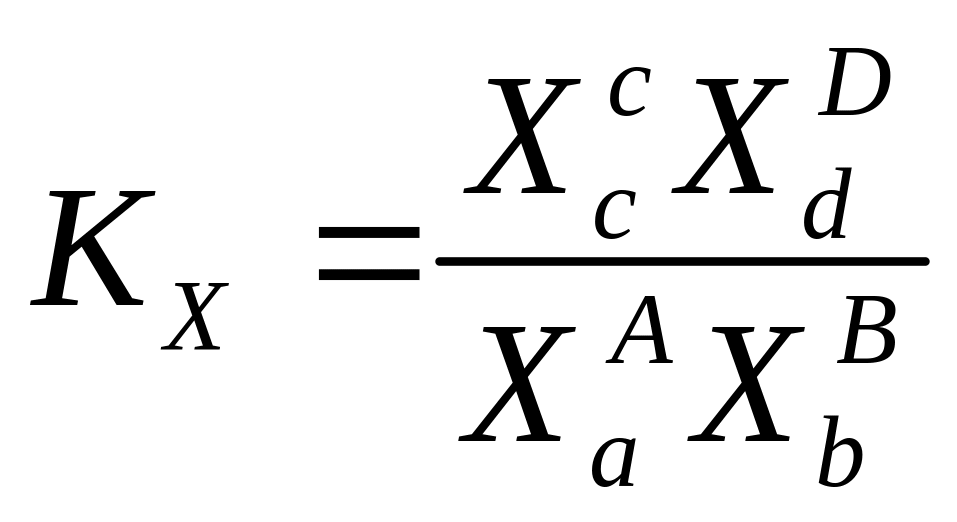
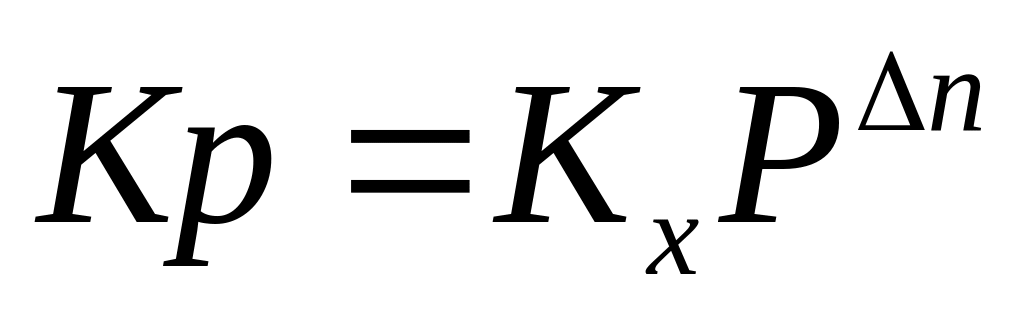
P-общие давление газов
Dn- изменение количества молей
