
- •Основные понятия термодинамики. Термодинамические системы, состояния и характеристики. Термодинамические процессы
- •2 Первое начало термодинамики
- •3 Первое начало термодинамики для различных термодинамических процессах
- •4 Работа расширения газа при различных термодинамических процессах
- •7 Теплоемкости веществ зависимость теплоты реакции от температуры уравнение Кирхгофа
- •2 Реакция нейтрализации
- •9 Второе начало термодинамики Энтропия
- •10Связьэнтропии с теплотой обратимого процесса математическое выражение второго начала термодинамики цикл Карно
- •11 Изменение энтропии в обратимых и необратимых процессах
- •12 Статистическая энтальпия
- •13 Третье начало термодинамики Расчет изменения энтропии при нагревании системы изотермическое расширение и сжатии газа и фазовых переходах Абсолютная энтропия
- •14Понятие о термодинамических потенциалах Закрытые системы изотермо- изохорные процессы свободная энергия Гельмгольца
- •15 Закрытые системы изотермо-изобарные процессы свободная энергия Гиббса для обратимых и необратимых процессов
- •Свободная энергия и направление
- •Изменение свободной энергии при изменении температуры и давлении
- •Расчет изменения энергии Гиббса в химических реакциях Стандартная энергии Гиббса образования и сгорания веществ
- •Химический потенциал
- •Равновесное состояние Закон действующих масс
- •21Энергия Гиббса Химических реакций
- •22Стандартное изменение Гиббса химической реакции зависимость dGр-ц от концентрации участников реакции
- •23 Закон Гесса для канстанты равновесия
- •24 Зависимость константы равновесия реакции от t
- •25 Принцип ле Шателье Влияние изменения давления на химическое равновесие
- •26 Фазовое равновесие, основные понятия и условия фазового равновесия
- •27 Правило фаз Гибсса
- •28 Уравнение клаузиса-клайперона общая форма
- •29 Зависимость давления насыщенного пара от температуры
- •67.Гальванические элементы и их электродвижущая сила (эдс)
- •68.Концентрационные цепи
- •69. Потенциометрия. Определение рН р-ров.
- •70.Средняя и мгновенная скорость хим. Р-ций. Закон действующих масс (здм) для скоростей. Константа скорости р-ции и период полупревращения.
- •71. Молекулярность и порядок р-ции.
- •74. Кинетика параллельных р-ций.
- •75. Кинетика последовательных р-ций 1-го порядка.
- •76.Кинетика обратимых р-ций 1-го порядка.
- •77. Кинетика сопряженных и цепных р-ций.
- •78. Влияние т на скорость х. Р. Правило Вант-Гоффа
- •80. Ур. Аррениуса. Определение энергии активации.
- •81. Катализ. Особ. Катализа. Мех-м….. Катализаторами
7 Теплоемкости веществ зависимость теплоты реакции от температуры уравнение Кирхгофа
Наряду с энтальпиями образования и сгорания непосредственное значение к теплоте имеет молярная теплоемкость вещества( количество теплоты требующегося для увеличения 1 моль вещества 1градС
С= дж/моль к
дж/моль к
2 частных случая теплоемкости
При постоянном объеме CV
При постоянном давлении СP
C=
,DQv=DE,
CP=DM ,Cv=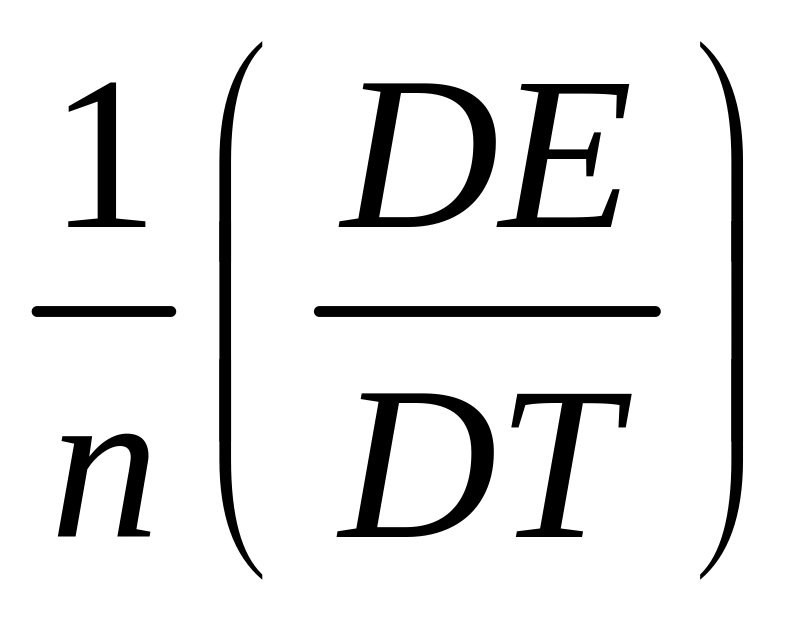 v.
v.
СP=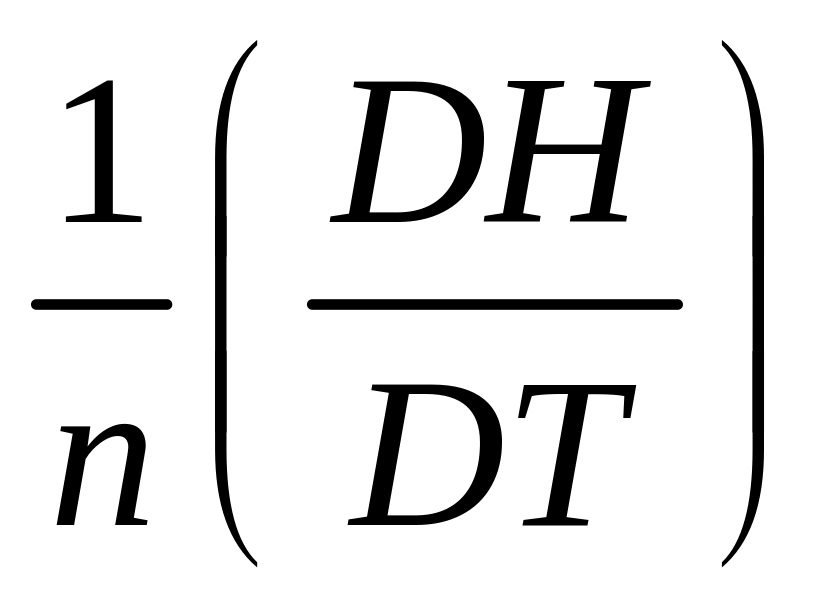 P
теплоемкость при постоянном V и P
P
теплоемкость при постоянном V и P
Связаны между собой
DH=DE+PDV=DE+NRDT
СP=CV+R
Зависимость теплоты реакции от температуры в ряде случаев теплота реакции зависит от Т наличия этой зависимости и сам ее характер определяется разностью теплоемкостью продуктов и реагентов
При P=const опред DСP
DCp=![]()
Если DCp>0 то значит что в ходе реакции образуется более теплоемкие вещества тогда при нагревании системы все большая часть теплоты должна как бы оставаться в продуктах реакции след. Выделение теплоты в реакции уменьшается
DCp<0-величина теплоты увеличивается т.к образуется менее теплоемкие вещества которые при нагревании поглощают меньше теплоты чем реагенты
Зависимость теплового эффекта реакции от температуры выражается уравнением
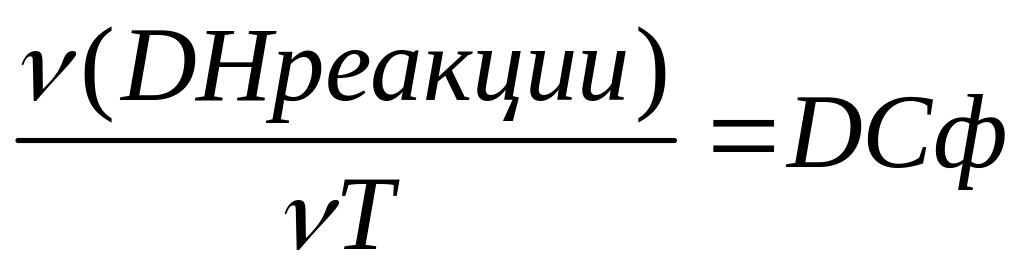 -уравнение Киргофа
-уравнение Киргофа
Теплоемкость веществ зависит от t от чего теплоемкость тоже будет различной это затрудняет точное интегрированием связи с чем пользуется приблизительным расчетом где используют среди значения теплоемкость вещества на рассматриваемом интервале t
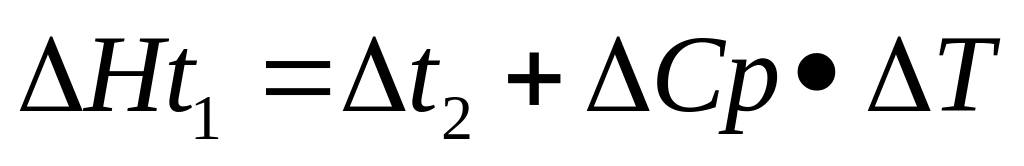
Если в заданном t интервале происходит фазовое превращение 1 или нескольких веществ то удобно Тепловой эффект рассчитывать на основании таблиц или табличных функций
![]() 8Теплоты
физико –химических процессов
8Теплоты
физико –химических процессов
1Растворение соли
Поскольку соль твердого вещества то при ее растворении последовательно протекают 2 процесса
Разрушение кристолической решетки----превращение
Эндотер DH>0
в ионы--------сольватация ионов
DH<0 экзотерм
DHраств=DHкр+DHсольв
Результирующий тепловой эффект процесса растворения =сумме DHкр и DHсольв С поглощением тепла растворяются нитраты а с выделением тепла сульфат меди есть ситуация когда присутствует только одна из названных стадий1 При растворении газа очевидно нет 1-ой стадии разрушения кристолическрй решетки остается только экзотер. сольватацияпоэтому растворение газов экзотермично2 при растворении кристаллов гидратация отсутствует стадия
сольватации остается экзотермическое разрушение кристолической решетки процесс идет с поглощением теплаРастворение сульфата меди (CuSO4)
1растворение кристалагидрата
CuSO4.5H2O(г)----CuSO4.5H2O(р)
DHраст=DHкр=11,7кДж
2 растворение безводной соли
CuSO4(г)—CuSO4(р)-------CuSO4.5H2O(р)
DHкр=11.7кДж / моль DHсоотв=-78.2кДж/моль
DHраспл=11.7+(-78.2)=-66.5кДж/моль
2 Реакция нейтрализации
Сильные кислоты и основания в растворе дисациируются полностью и поэтому теплота интрализации не зависит от них природы
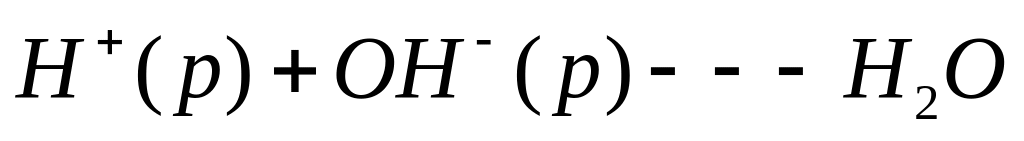
DHf 0 -230 -286
кДж/моль DHнейтр=-286+230=-56кДж/моль
если в реакции нейтрализации участвует слабый электролит то процесс нейтрализации будет идти в две стадии на первой стадии происходит ионизация слабого электролита (диссоциация DH>0) а на 2-ой нейтрализации
HA---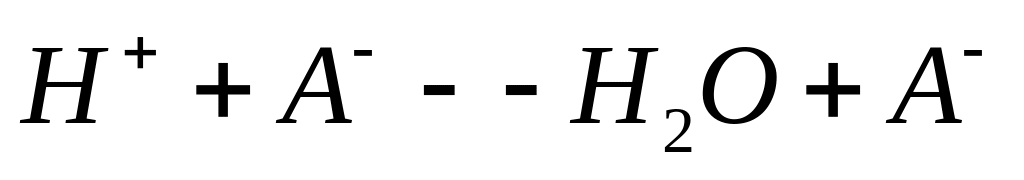
DHдис>0 DHнейтр<0
DH=DHдис+DHнейтрЧем слабее электролит тем больше необходимо веществу передать тепла
Диссациация и нейтрализация H2CO3
H2CO3---
-700 дис1
![]()
-691 дис2 0 -676
DHдис1=-691+700=9кДж/моль
DHдис2=-676+691=15 кДж/моль
DHреакции=DHдис1+DHдис2+2DHнейтр=88кДж/моль3)фазовое превращение
Теплоты фазового перехода=разности DHобразования вещества в одном и другом состоянии для воды в процессе испарения DHисп=-242+286=кДж/моль
H2O(Ж)= -286 H2O(Г)=-242
